前段时间mRNA研究刚获诺奖,现在Nature杂志即预言环状RNA将会是下一代重磅药物,那什么是环状RNA?为什么环状RNA会是下一代重磅药物?今天来和大家聊聊。

这真的是让人兴奋的事,因为这次,真的可能打开了一扇新大门。这绝不是单纯的疫苗,而是治疗各种疾病的新思路。
01,做疫苗的诺奖?你真的低估了它的真实价值
2023年的诺贝尔生理或医学奖可能是这些年来最让人熟知的诺贝尔科学类奖项了,毕竟这次诺奖的现实应用就是mRNA新冠疫苗,而诺奖得主之一的Katalin Karikó更是被称为mRNA疫苗之母,要知道新冠堪称过去几年全人类绝对的主题词,不论男女老少都被这个21世纪以来最大的疫情所席卷,覆盖面之广也是罕见的。而新冠mRNA疫苗则是疫情应对中最亮的崽,快速的设计疫苗、简单的生产办法、卓有成效的免疫效果,让mRNA疫苗深入人心,而这,竟然是mRNA疫苗第一次在人群中现实应用,堪称出道即巅峰。
正因为mRNA疫苗大家都熟悉,所以有不少人对此颇有微词,毕竟简单易懂嘛,可不像细胞自噬、囊泡运输、基因编辑之类的看起来就不懂但是觉得高大上的样子,而且应用范围好像也不大嘛。真的如此吗?你可能低估了它的潜力!做疫苗只是mRNA疫苗的牛刀小试,它的应用潜力广的很。
不信你想一下mRNA疫苗的原理。生物是有一套专门的系统,可以在mRNA指导下合成蛋白质,这个过程就被称为翻译。
而mRNA疫苗的原理就是将mRNA这个菜单送给细胞,然后细胞在它的指导下,利用自身的系统将mRNA翻译成为对应的蛋白质。由于这段mRNA是病毒的抗原序列,所以免疫系统会识别这种抗原并开启免疫应对,于是就实现了免疫效果。
等等,你有没有注意到这里面的关键信息:给细胞一个mRNA菜单,然后让它合成蛋白?
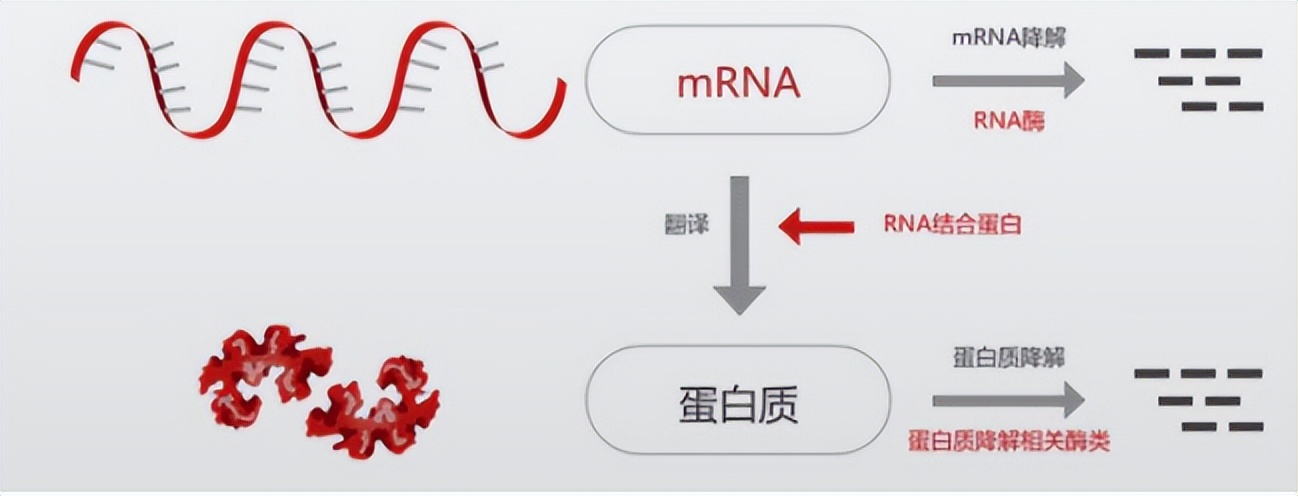
这可不简单,要知道,蛋白质是生命活动的主要承担者,无论是细胞的结构、还是催化、运输、调节、免疫都离不开蛋白质。而绝大多数疾病本质上也是蛋白质出现了异常,比如癌症,虽然根源在于DNA变异,但是从DNA变异到最终转变为癌细胞并且呈现出癌症特征,还是蛋白质在发挥作用。再比如,各种遗传病,同样也是DNA出了问题最后导致在蛋白质上出现异常从而引发了各种疾病。
既然mRNA能够指导细胞合成蛋白质,那么,我们一直以来面对的难题:如何解决蛋白质问题,似乎就有了解决思路,那就是,从mRNA入手。
事实上,这可不是幻想,而是现实和前景,这一点在诺贝尔奖官方的介绍中也提到了,那就是可以用于递送用于治疗的蛋白质以及治疗癌症等。

怎么样,意识到这诺奖的价值了吧?可不只是用于疫苗,而是有更多的用途的,尤其是对癌症和遗传病这种更严重的且缺乏有效治疗手段的领域。
02,mRNA的易降解问题
不过,想要让mRNA能够有更广泛的应用,我们还需要解决一个问题,那就是mRNA的易降解问题。
mRNA是线性的单链结构,本身结构就不像DNA那样双链互补,不容易使得碱基外漏,结果就是,mRNA很容易就被细胞中的RNA酶结合上去,这些酶会结合结果就是mRNA非常容易被降解掉。事实上,细胞中的mRNA更新频率非常高,从细胞功能的角度,这有利于细胞更高效率的利用核糖核苷酸,让细胞的效率提高。
但是,对于mRNA的应用,可就没那么美妙了。想一下,比如遗传病,它需要的是mRNA长时间持续发挥作用,这样才能修正细胞的错误,对于癌症同样如此,需要不断地去发挥作用去针对癌细胞。但是线性mRNA非常容易降解,可能几个小时就没了,那结果就是,只能在极短时间内发挥作用,疗效自然就难以谈了。
当然,对于疫苗来说倒是问题不大,毕竟疫苗短时间产生抗原激发人体的免疫就可以发挥作用了。但是对于长期的治疗,那就不太可行了。所以,能不能解决这个线性mRNA易降解的问题呢?
答案是可以的。mRNA容易降解的原因在于线性mRNA会被核酸外切酶结合开启降解,这种降解过程涉及到了mRNA的末端polyA水解以及mRNA依次降解,也就是常见的脱腺苷酸依赖型降解,通俗的说,就是相应的酶会在线性mRNA的端部结合开启降解。
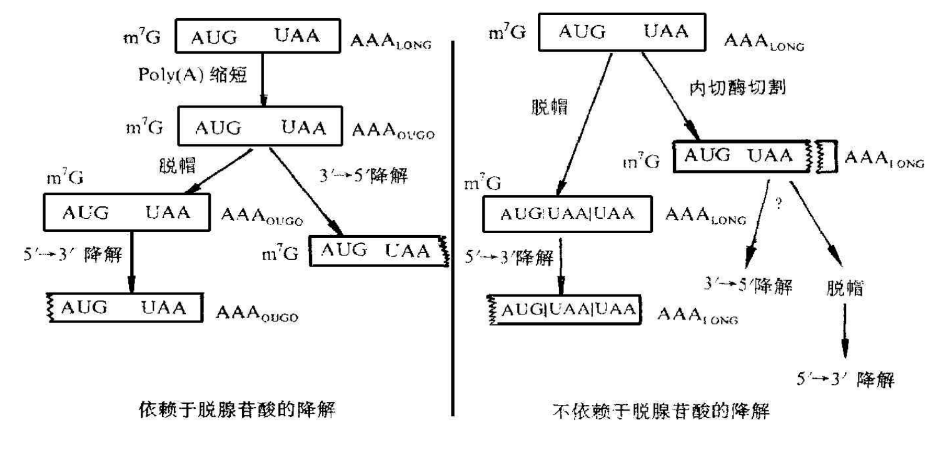
由此可见,线性mRNA的端部外露是让线性mRNA降解的重要因素。
既然如此,那么我们能不能让mRNA的端部减少暴露呢?这个时候,就要发散我们的思维了,线性的mRNA,无论怎么修饰,始终会存在外露的端部,那么我们能不能让线性mRNA的两端连接起来形成一个环状,这样就可以尽可能的避免外露的端部,于是形成一个更不容易降解的mRNA呢?
Bingo,这就是环状mRNA,也就是circRNA。将RNA连接成一个环状,这样可以尽可能的减少RNA酶的外切作用,但是又可以让RNA拥有像线性mRNA那样指导细胞来合成蛋白实现后续的医学功能,可以说是一个完美的思路。
不过,可能你会有一个疑问,这环状RNA真的能够实现吗?因为聪明的你一定也会意识到,将RNA形成环形肯定是不容易的,而且,环形是可以减少RNA降解相关酶的结合,但同时也意味着那些指导RNA翻译成蛋白质的相应酶也更难以结合了啊,那还有什么意思呢?
其实解决这个谜团,还是要我们回归到环状RNA的发现研究之旅,因为这些生物中本身存在的RNA才是我们新思路的根本来源。
03,circRNA的发现
其实早在1976年,科学家就首次在植物病毒里发现了呈现闭合状态的环状RNA,并随后在真核细胞里也观察到了环状RNA的存在。不过当时研究人员也没太在意,可能觉得这是一种错误或者异常的剪辑存在。直到多年后,随着环状RNA的存在被越来越多的观察到,而且还表现出了细胞或者组织特异性表达的特点,这就意味着,环状RNA绝对不是随机或者错误产生,而是一定有相应的作用的,毕竟生物可不会浪费能量去专门生产这些特异性的环状RNA。
于是研究人员开始正式将视线瞄准了环状RNA,环状RNA的作用才开始不断被发现不断的颠覆了传统的认知。
比如,环状RNA可以作为天然小RNA的吸附海绵体,这样就能了解小RNA的活性,比如它可以与转录元件结合从而调控多种基因的转录,它还可以和蛋白质相互作用来发挥作用。这也使得环状RNA在糖尿病、心血管疾病、神经系统疾病乃至是癌症中都有相应的影响,还可以作为多种疾病的生物标记物。
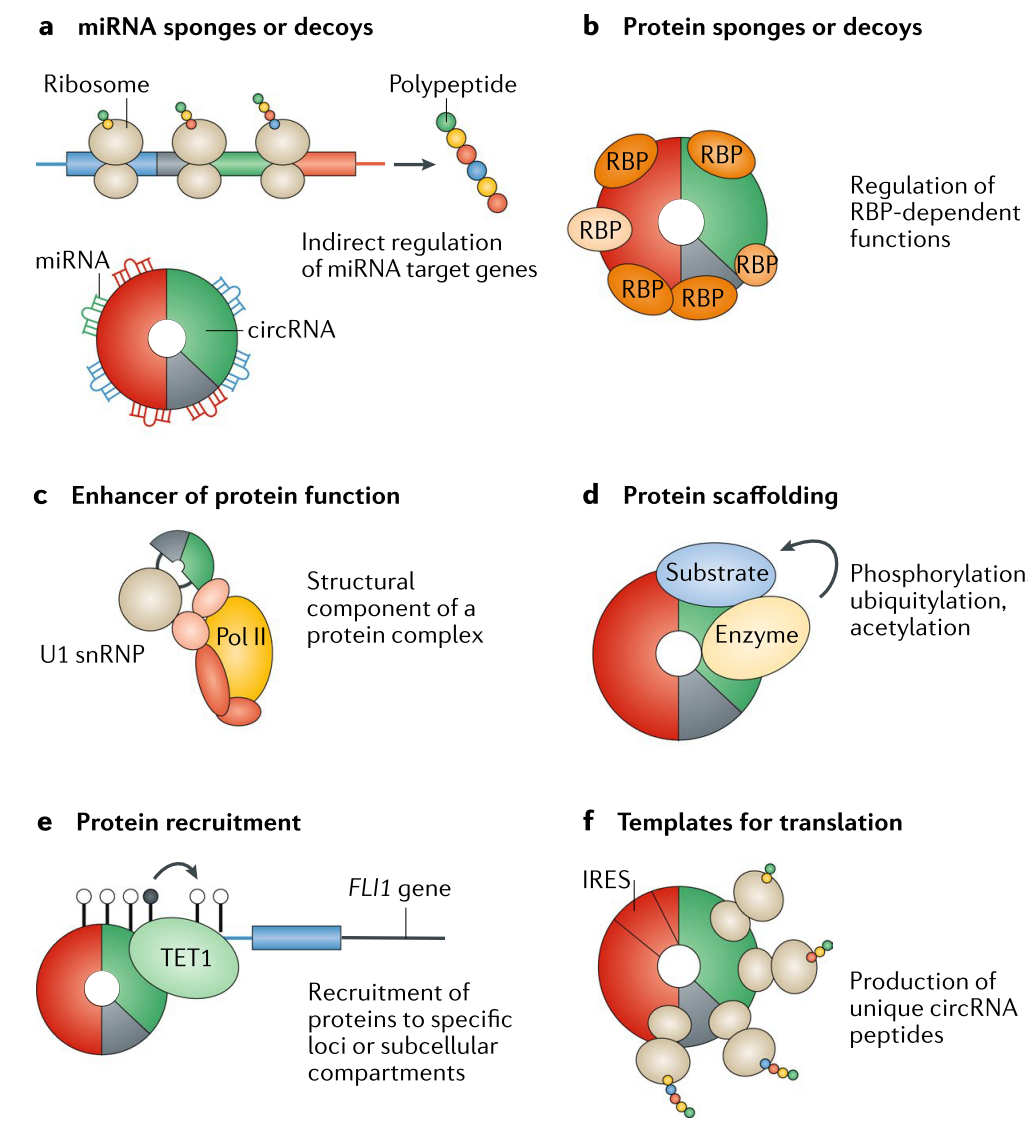
而特别让科研人员感到惊喜的是,环状RNA竟然可以翻译成为蛋白质!
要知道,蛋白质是生命体的主要功能承担者,翻译成蛋白质这就意味着circRNA可以发挥和正常基因一样的功能来,那这就意味着,circRNA能够打开广阔的治疗空间,不只只是像线性mRNA短期的发挥作用,而是能够长效的起到效果。
于是,circRNA的新时代来到了:用circRNA来作为新的治疗策略。
当然,事情肯定不是那么顺利的,因为还是有很多问题需要解决的。比如,circRNA是如何形成的呢?这个问题很关键,它关系到了我们如何制作circRNA。
在传统的认知里,从DNA转录出来的RNA是会经历一系列剪切,从而形成成熟的mRNA,这其中的剪切是有许多策略,比如直接剪切、跳跃等等,最终可以让哪怕是同一个基因都可以形成不同的mRNA进而产生多样化的蛋白质,这也是我们生物功能多样化的基本保障。
不过,这些剪切形成的主要是线性mRNA,为什么会形成环状RNA呢?科学家们对其进行了研究,目前已经提出了一些假说,典型的是反向剪接理论,认为一部分RNA会将上游和下游的剪接位点连接起来形成闭合的环状RNA。当然,也有理论认为可能是外显子的跳读形成了套索进一步环化而成。
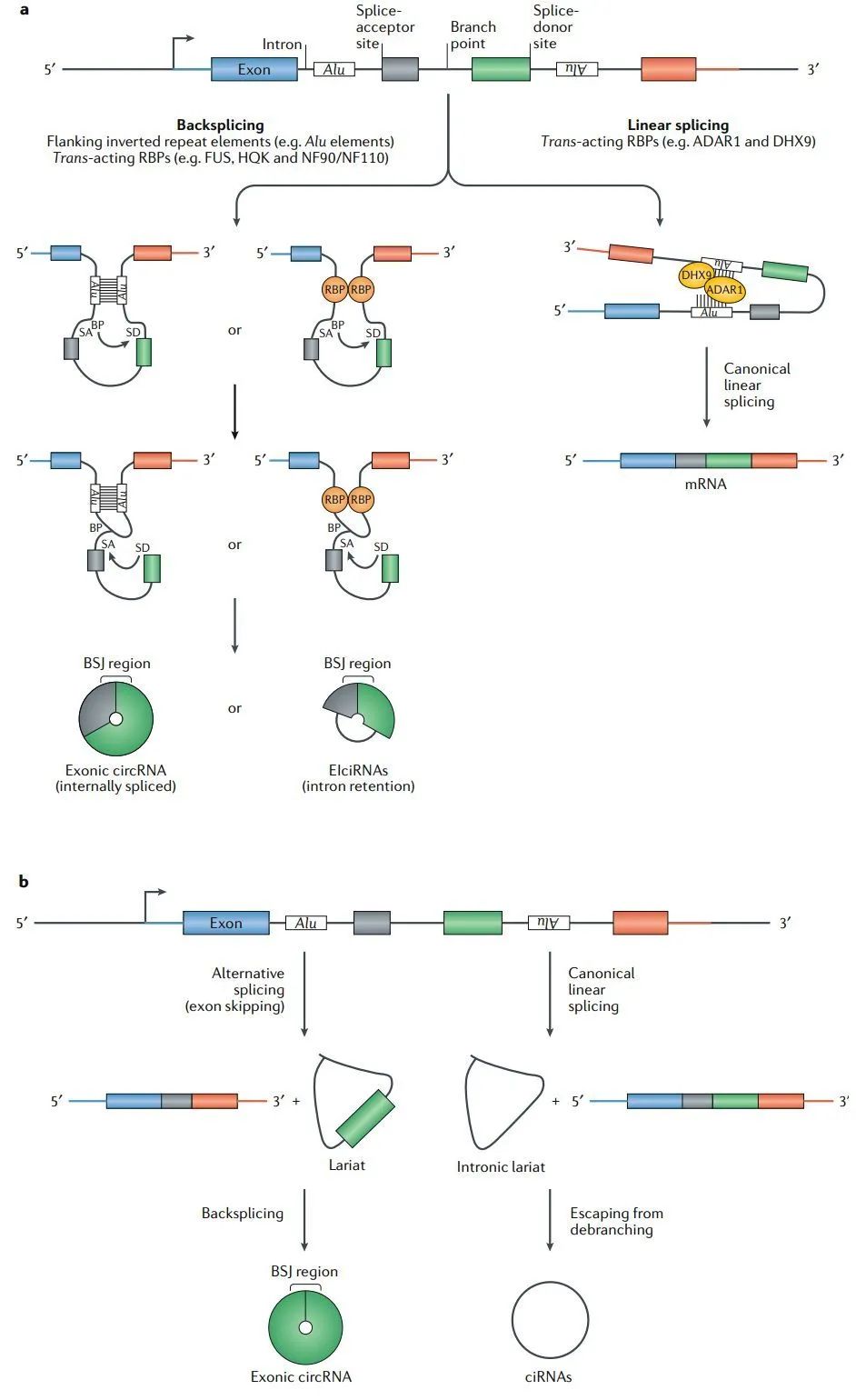
不管如何,至少这些理论佐证了环状RNA的形成是可行的。
04,遗传病的解决新思路
有了这些理论武装和准备,那么人工的合成circRNA就开始走上了正式道路,因为这将给我们解决许多生物学难题以及不治之症提供新的武器。
举个例子,有一种遗传病叫做杜氏肌肉营养不良症( Duchenne Muscular Dystrophy,DMD),这是一种遗传性肌肉萎缩疾病,会出现腿部无力、肌肉萎缩、骨骼肌退化等症状,大家可以想象,肌肉是我们活动的主要结构,因此一旦出问题,那可就麻烦了,所以杜氏肌肉营养不良症往往会导致行走功能退化,最后走向死亡。而引发这种疾病的原因就是人体的基因发生了变异,位于X染色体上编码抗肌萎缩蛋白(Dystrophin)的基因发生了变异,于是相应的蛋白出现问题,最终形成了疾病。
因为基因出了问题,导致蛋白出现问题,最终出现疾病,这在现代医学上是绝望的,没有什么药物可以做到全部去干预如此大规模的肌肉群。
但是circRNA的出现为这种疾病的治疗打开了一扇窗。就像我们前面提到的,DNA转录成为RNA然后进一步翻译成蛋白质,而我们如果能够在RNA这一步给它予以补充,那么从RNA到蛋白质的部分就可以恢复过来,于是这种疾病就有了治疗。
传统的线性RNA易降解问题一直难以解决,但是有了circRNA,这就不再是问题了,比如目前Orna Therapeutics已近将编码杜氏肌营养不良(DMD)所缺乏的肌营养不良蛋白(Dystrophin)的mRNA实现环化,这样就可以将这种circRNA导入到患者细胞中,通过RNA的长效表达直接从根本上解决杜氏肌营养不良。
可以看到,这是一种非常新的技术,也是应对传统遗传病的重要策略,毕竟对于成人来说,全身的细胞更换DNA是不可能的,但是改变RNA却是一个可行的操作。
事实上,circRNA的应用不只是遗传病,包括我们目前面临困难的癌症,也可以通过circRNA来改变其基因表达来实现新的治疗。
由于circRNA的全新优势,在mRNA技术获得2023年诺贝尔生理或医学奖之后,顶级期刊Nature随即发表了相应的文章,指出circRNA是RNA治疗的下一个重大突破口。

由于circRNA的治疗优势和前景,目前多家机构已经纷纷涌入到circRNA领域,比如国外的Laronde、Circular Genomics、Orna Therapeutics等,国内也不甘落后,比如前几天在苏州吴中举办的生命科学创新生态联盟首届创新诊疗产业论坛上,就有不少关于环状RNA的讨论。
此次会上,国际环状RNA技术领军人物、Orna Therapeutics公司联合创始人Alex Wesselhoeft博士也公布了其与菲鹏集团展开在环状RNA领域合作的信息,双方联合成菲鹏弘济生物公司、并将专注于环状RNA技术平台开发及创新应用项目早期研发。双方将全力打造全球领先的核心平台,包括环状RNA设计及工程化平台、创新疫苗形式、创新递送平台等,高效解决环状RNA产业化的关键技术瓶颈,以创新技术引领行业发展。感觉这次国内在这方面也跟上了风口,毕竟circRNA的前景实在是太吸引人了,甚至比起传统基因编辑更有吸引力。
我们曾经笑话“21世纪是生命科学的世纪”,但是目前来看,似乎痕迹越来越明显了,就是生命科学真的在解决一些传统过去一直无法解决的问题,包括遗传病这种传统的疑难杂症,感觉再发展几十年,说不定真的会出现超级现象级的突破。
ABIO, B. "RNA THERAPEUTICS’NEXT BIG THING IS THE RING." Nature 622 (2023): 5.
Kristensen, Lasse S., Maria S. Andersen, Lotte VW Stagsted, Karoline K. Ebbesen, Thomas B. Hansen, and Jørgen Kjems. "The biogenesis, biology and characterization of circular RNAs." Nature Reviews Genetics 20, no. 11 (2019): 675-691.
来源: 李雷


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 李雷
李雷 
