抗微生物药物耐药性(AMR)已成为全球最严峻的公共卫生挑战之一。耐药病原体的持续扩散导致临床感染治疗面临药效下降、病死率上升、住院时间延长和医疗成本增加等多重压力。2019年,全球约有500万人死于AMR相关感染[1];世界卫生组织(WHO)预计,若不采取有效干预,至2050年AMR相关死亡人数可能增至1000万例,经济损失将高达100万亿美元[2-3]。
AMR的流行受多种因素驱动,包括抗生素过度使用等、人口流动、环境污染及抗菌药物在农业中的滥用等,这些影响在中低收入国家尤为显著[4]。近年来,以大肠埃希菌、肺炎克雷伯菌和鲍曼不动杆菌等为代表的多重耐药病原体在临床广泛流行,进一步加剧了感染防控的难度[5-6]。面对日益复杂的耐药防控局面,临床与公共卫生对信息的时效性和整合分析能力提出了更高要求。病原检测结果、药敏谱、患者特征及院感监测等多源异构数据不断增长,仅依赖人工处理和经验判断,难以高效支持实时决策与精准干预。尽管传统检测方法在诊疗中不可替代,但仍需辅助性工具提升数据利用效率与决策支持能力[7-8]。
在此背景下,人工智能(AI)技术的快速发展为AMR防控提供了新的解决方案。其中机器学习(ML)和深度学习(DL)具备强大的数据挖掘与模式识别能力,能够有效整合基因组信息、电子病历与流行病学数据,可应用于耐药性预测、病原体识别、个体化治疗推荐、新药研发及抗菌药物管理等多个关键环节[9-13]。AI的引入不仅提升了数据处理效率,也为实现更快速、精准的感染防控提供了可能。本文将系统阐述AI技术在微生物耐药防控中的临床应用(图1),重点探讨其在流行病学监测、耐药性检测、临床决策以及新药研发等领域的应用价值,旨在为相关领域的基础研究及临床实践提供理论依据。
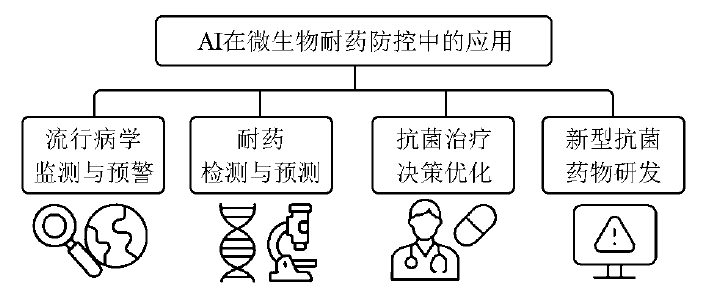
图1 AI技术在微生物耐药防控中的应用
AI(artificial intelligence):人工智能
1 AI在流行病学监测与预警中的应用
1.1 基于大数据的耐药趋势预测
基于ML模型,可对历史耐药率、抗菌药物使用数据及相关社会经济指标进行建模,预测未来特定病原体对抗菌药物的耐药趋势,为公共卫生干预与资源配置提供数据支持。
以英国一项多中心研究为例,研究者整合了英国119家医院2016年4月至2022年3月的病原体耐药率与2014年4月至2021年3月的抗菌药物使用数据,采用XGBoost算法建立预测模型,预测下一年度的耐药水平变化,发现该模型在多数情境下的预测误差低于传统时间序列外推法,尤其在耐药率波动较大的医院中展现出更优的预测效能。
进一步的特征重要性分析表明,除历史耐药数据外,不同病原体对同类抗菌药物的交叉耐药关系、抗菌药物使用量等非线性因素,均显著提升了模型精度[14]。这体现出AI在捕捉复杂变量间潜在关联方面优于传统分析方法。此外,该研究还指出,模型可通过纳入如COVID-19疫情及其防控措施等突发因素,提升对外部干预事件的适应性[14]。
基于此类预测结果,卫生管理部门能够更早识别耐药率可能上升的区域[如耐甲氧西林金黄色葡萄球菌(MRSA)高风险地区]或菌株,针对性优化感染控制措施及抗菌药物管理(AMS)策略,合理配置医疗资源。与此同时,趋势预测模型亦可为抗菌药物的供应管理提供重要参考信息,助力精准规划未来用药需求,避免短缺或浪费[15]。
1.2 基于多源数据的早期预警系统构建
AI在传染病早期预警中的潜力已在COVID-19大流行中初步显现。2019年12月,加拿大BlueDot公司基于AI系统,通过扫描全球新闻、航空客流和疾病通报,率先发现中国武汉的不明原因肺炎聚集性病例,较WHO官方通报提前数日[16]。该事件表明,AI可作为“数字流行病学家”,在传统公共卫生响应前实现预警。
在AMR防控中,AI同样支持多层级的风险监测与趋势识别。借助自然语言处理(NLP)和ML技术,AI可整合实验室检测、电子病历、畜牧业用药、社交媒体等多源数据,实时监测耐药动态。一旦发现某地耐药性病原体数量激增或特定耐药基因频繁出现,系统便可自动触发预警,提示潜在疫情风险[17-18]。
在医疗机构内部,AI也正被用于实现更精细化的早期识别。以杜克大学的“Sepsis Watch”为例,该系统通过深度学习模型,分析ICU患者的生命体征和检验数据,能够早于临床医生发现脓毒症高风险患者,显著提高干预时效性[19]。类似方法还可用于评估多重耐药菌感染风险,结合患者既往病史、侵入操作与病房暴露信息,辅助决策隔离与用药策略。同时,结合NLP技术,部分系统还可动态监测病历文本,识别如持续发热等警示信号,提示医生调整方案[20]。尽管仍存在数据质量及误报控制等挑战,AI凭借其自动化与实时处理能力,有望显著提升AMR预警的敏感性与响应速度,为公共卫生与医院感染管理提供有力支持。
1.3 基于基因组的耐药菌传播溯源
耐药菌在医院和社区中的传播常具有隐匿性,主要通过无症状定植者在人际间传播,一旦暴发可能对患者安全构成严重威胁。AI技术通过整合分子流行病学数据与患者接触网络信息,可有效识别病原体的传播聚集性及感染来源,从而提升感染控制效率[21]。在分子水平上,基于全基因组测序(WGS)的ML算法可对大量临床分离株进行高通量聚类分析,识别高度同源的菌株群,提示潜在的传播克隆或暴发簇。例如,利用聚类算法分析MRSA基因序列,可从上千个菌株中迅速筛选出基因组高度相似的菌群,进而锁定可能发生于医院内部的传播事件[22]。
此外,AI还能整合WGS数据与患者入出院记录、病房分布、时间轴等元数据,重建传播链。研究表明,基于ML的多维度模型能有效识别传统人工方法难以发现的隐性传播路径[13]。例如,某些患者因在同一时间段内入住同一病房而感染了高度相似的耐药克雷伯菌菌株,AI模型可在基因组层面关联这些病例,为感染控制措施(如病房隔离、环境消毒)提供证据支持[23]。
近年来,匹兹堡UPMC长老会医院发生的NDM-5产酶肠杆菌科多物种暴发事件,充分验证了基因组溯源在厘清传播链中的重要性。该研究采用的EDS-HAT系统融合WGS监测与ML方法,不仅提升了暴发检测的灵敏度,还能精准识别可能的传播路径[24]。AI技术的引入不仅提升了分析效率,降低了人工误差,还使病原追踪更加及时、精准。
2 AI在耐药性检测与预测中的应用
快速、准确检测细菌耐药性对指导临床合理用药和感染防控至关重要。目前,临床常规检测仍主要依赖传统体外药敏试验(如纸片扩散法和最低抑菌浓度测定),通常需要2~3 d才能获得结果,且必须基于纯培养物,这种时间延迟可能导致错失感染早期的最佳治疗窗口。近年来,AI技术为提升耐药性检测效率提供了新途径,尤其体现在基于基因组测序数据的基因型耐药预测与基于表型数据的快速辅助诊断方面。
2.1 基于基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)数据的耐药性预测
Weis等[25]通过构建包含30余万例临床菌株的MALDI-TOF MS质谱数据和75万条药敏记录的大规模训练集,开发出可直接预测耐药性的DL模型。该模型在主要病原菌中的预测效能良好,对金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯菌的曲线下面积(AUC)分别为0.80、0.74和0.74。回顾性分析表明,该模型推荐的抗菌药物调整方案中89%被证实更为有效,凸显其临床决策潜力和部署优势。
为验证该模型的普适性,Chung团队[26]进一步将研究范围扩展至鲍曼不动杆菌、医院获得性不动杆菌、耐万古霉素肠球菌和B群链球菌等多种病原体,并比较了三种质谱预处理方法,发现采用集成预处理策略结合随机森林模型可显著提升预测准确率(在外部测试集中分别达到84.4%、91.0%、78.5%和70%以上),证实质谱数据预处理对模型性能具有决定性影响。
在方法学优化方面,Nguyen等[27]针对铜绿假单胞菌开发了动态分箱特征提取法。该技术通过降低特征维度有效避免了过拟合问题,使模型对多种β-内酰胺类药物的预测AUC值均超过0.85,显著拓展了AI技术在复杂耐药表型中的适用性。值得注意的是,针对甲氧西林敏感金黄色葡萄珠菌(MSSA)/MRSA等具有高度谱图多样性菌株的AI识别研究,模型预测可能出现“灰区”现象,提示在训练集中需要充分覆盖菌株谱系及样本多样性,从而强化模型泛化能力[28]。
2.2 基于基因组数据的耐药性预测
细菌和真菌的耐药表型与其基因组中的特定耐药基因或突变位点密切相关,使基因组测序预测耐药谱成为可能,有望突破传统培养方法的局限性。随着二代和三代测序技术的成熟,临床获取微生物全基因组数据更加便捷,为AI模型的训练提供了充分的数据支持。
ML和DL技术能够有效识别基因组特征与耐药表型之间的复杂对应关系,实现从基因型到表型的精准预测。以结核分枝杆菌为例,传统药敏试验耗时数周,而Walker等[29]利用10 000余株结核菌的基因组与表型数据构建ML模型,成功预测异烟肼和利福平的耐药性(灵敏度分别为97.1%和97.5%,特异度分别为99.0%和98.8%)。该模型的预测结果与传统药敏试验高度一致,证实了基因组预测的临床可靠性。
类似方法也应用于MRSA、大肠埃希菌和肺炎克雷伯菌等常见耐药菌的预测,这些研究采用多种算法(包括XGBoost、随机森林、神经网络等),能够自动识别关键耐药突变位点组合,实现高通量预测[30-31]。与PCR等靶向检测不同,AI模型可处理全基因组信息,具备发现新型耐药机制的潜力[32]。此外,借助纳米孔等实时测序平台,该模型可当天完成测序与耐药性检测,显著加快感染诊治进程[33]。
3 AI在抗菌治疗决策中的应用
在感染性疾病的临床诊疗过程中,抗菌药物的合理使用面临药物选择、剂量调整、疗程确定及个体化治疗等多重挑战。随着耐药形势日益严峻,优化抗菌药物使用策略不仅有助于提高疗效,亦可降低药物不良反应和耐药性发展风险。在这一背景下,临床决策支持系统(CDSS)正逐渐成为抗菌治疗的重要辅助手段,通过整合电子病历、实验室检查、微生物检测和临床指南等数据,基于AI的CDSS系统可生成个体化用药建议,从而提升抗菌治疗的精准性和合理性[34]。
3.1 AI驱动的CDSS系统开发
抗菌药物滥用是耐药性加剧的关键因素。CDSS系统可在处方开立时提供实时建议,是AMS的重要工具。传统CDSS系统依赖规则设定,而AI驱动的CDSS系统结合机器学习与大数据,提供更具针对性的处方建议。例如,以色列Maccabi医疗集团开发的“UTI Smart-Set (UTIS)”系统,通过整合电子病历、本地耐药谱及ML预测模型,为尿路感染(UTI)患者推荐个体化用药。
2021年6月至2022年8月,该系统共介入7.5万余例UTI病例,医生对其推荐的采纳率达66%。在尿培养结果为阳性的病例中,采纳组抗菌药物失配率(即病原体对所选抗菌药物耐药率)为8.9%,显著低于未采纳组的14.2%;其中50岁以上女性患者失配率下降尤为明显,降幅达55.6%。同时,该系统更倾向于推荐窄谱抗菌药物,使得环丙沙星使用率从32.9%降至6.4%,使用量减少超80%,有助于降低细菌耐药性[34]。国内多家三甲医院也已将AI推荐算法整合至抗菌药物预警系统,使处方合理率从90.47%升至95.35%[35]。
另有一项研究通过深度集成知识库与电子病历数据,建立了抗菌药物使用全流程管控系统,优化了临床用药结构,显著减少了广谱药物的使用[36]。此外,中国医学科学院阜外医院开展的计算机化抗菌药物管理系统(EPIC)随机对照试验证实,CDSS干预可有效减少围术期抗菌药物使用,且维持良好的感染控制效果,为其在临床的推广应用提供了有力支持[37]。
在欧美等国家和地区,CDSS已被嵌入电子医嘱系统,可根据感染部位、微生物检测结果、既往用药史等信息,提示推荐使用的抗菌药物及相关耐药率,并对不合理用药进行自动预警。此类系统显著降低了初级保健中不合理用药比例,尤其在上呼吸道感染等易出现抗菌药物滥用的场景中,能够辅助临床医生区分病毒感染与细菌感染,从而减少不必要的抗菌药物使用[9,38]。
3.2 个体化用药与剂量优化
耐药感染治疗需考虑患者年龄、基础疾病、器官功能状态等差异,这些因素直接影响药物在体内的代谢与分布。基于AI技术的CDSS系统可整合患者的基本信息、实验室检查数据、药动学/药效学(PK/PD)特征及微生物检测结果,提供精准用药建议。
一方面,AI可助力PK/PD建模与剂量优化。对需进行药物浓度监测(TDM)的药物(如万古霉素、氨基糖苷类),已有研究利用贝叶斯模型实时分析血药浓度,预测个体最佳剂量,减少肾毒性等不良反应的发生风险[39]。韩国庆熙大学研发的JointMLP模型,在ICU患者中将TDM预测误差分别降低了约31%和81%[40]。韩国梨花女子大学开发的OPTIVAN算法,则可预测初始给药剂量是否达到治疗窗,其在训练集和验证集中的受试者工作特征曲线的AUC分别为0.832和0.720,且在多个亚组中表现稳定,目前已被开发为网页工具供临床进行实时决策[41]。
另一方面,AI还能根据年龄、体重、器官功能、合并症、过敏史和微生物信息,推荐复杂感染(如儿童败血症、老年肺炎、免疫抑制患者感染)的个性化用药组合。通过模型可预测早期可能感染的病原体及其耐药谱,提出经验性治疗建议,并根据培养结果动态调整治疗方案。与传统指南相比,AI提供的治疗方案更具适用性和准确性,有助于降低经验性治疗失败率及药物的毒副作用[42]。
此外,AI还可辅助抗菌疗程管理,如动态分析炎症指标(C反应蛋白、降钙素原)、病原体清除情况及器官功能恢复趋势等,预测患者是否可提前停药,从而避免过度治疗以及耐药风险[43]。近年来提出的抗菌学习系统(antimicrobial learning system)通过AI预测病原体及其耐药性,优化早期经验性治疗方案并识别高风险患者,提升治疗效率并有效控制了交叉感染[42]。
4 AI在新型抗菌药物研发中的应用
4.1 基于虚拟筛选的抗菌先导化合物发现
AI在抗菌药物研发中的一大优势是其高通量虚拟筛选能力,能够快速探索庞大的化学空间,发现传统方法可能遗漏的潜在活性分子,为新药研发带来突破性进展。2020年,麻省理工学院Collins团队开发的深度学习模型便成功发现了广谱新型抗生素Halicin。该模型基于约2500个分子的抗大肠杆菌活性数据进行训练,并在超过1亿个小分子的数据库中筛选出多个候选分子,Halicin即为其中之一[44]。
实验结果显示,Halicin对多种耐药菌株(包括结核分枝杆菌和泛耐药鲍曼不动杆菌)具有显著杀菌活性。在小鼠感染模型中,Halicin可在24 h内清除伤口中的耐药细菌,并在连续用药30 d后仍未诱导出耐药性,效果远优于对照药物环丙沙星。此外,其杀菌机制是基于干扰细菌细胞膜的电化学梯度,与现有抗生素不同,因此交叉耐药风险较低。这一成果突显了AI在发现结构新颖、机制独特的抗菌分子方面的潜力。
继Halicin之后,研究者进一步将图神经网络应用于靶向鲍曼不动杆菌的药物筛选[45]。通过训练模型识别约7500种分子的抑菌数据,成功发现了窄谱抗生素Abaucin。该分子对鲍曼不动杆菌具有选择性杀菌作用,且机制新颖,通过干扰脂蛋白运输系统中的LolE蛋白发挥效应,填补了该作用靶点领域的研究空白。该研究展示了AI在特定病原体靶向药物研发中的高效性,为窄谱抗生素研发提供了新范式,尤其适用于针对医院常见耐药菌的精准治疗。
4.2 基于结构优化的抗菌分子设计
人工智能在抗菌分子的设计与优化方面同样展现出显著优势。通过学习已有抗菌化合物的结构-活性关系,AI模型可生成结构合理、活性更优的新型分子。例如,强化学习模型[46]可设定多维优化目标(如增强抗菌活性、降低哺乳动物细胞毒性),自动提出创新性的结构修饰方案,为药物化学家提供设计思路。
目前,AI辅助设计已被成功用于现有分子的优化与新结构的生成。有研究团队开发出多任务深度学习模型APEX,通过分析灭绝生物的蛋白质组数据,可识别出具有广谱抗菌活性的肽类分子,并在动物实验中验证了其体内抗感染效果[47]。
此外,AI在靶点对接分析与药效团提取方面的技术也日益成熟,能够辅助优化候选分子与靶蛋白的结合构象。目前已有研究致力于构建独立于传统分子对接方法的机器学习模型,用于预测肽-蛋白相互作用[46]。制药企业也借助AI技术优化抗菌肽的氨基酸组成,以提升其稳定性、降低毒性。通过精准预测理化性质与结构活性关系,AI显著加快了抗菌新药的设计、评估及迭代优化过程。
5小结与展望
AMR问题因其复杂性与全球性特征日益严峻,对公共卫生安全和临床治疗构成挑战。在传统诊疗模式与药物研发周期难以满足现实需求的背景下,AI在应对AMR问题中已展现出巨大潜力与实际价值。目前,该技术已在多个环节展现出显著的可行性与临床应用前景。例如,利用ML分析微生物基因组信息,可在短时间内精准预测耐药性;基于DL的质谱与图像识别算法,显著提升了传统表型检测速度与标准化程度;整合多源临床数据的CDSS系统,不仅优化了抗菌药物处方的合理性,还推动了AMS的个体化发展;AI驱动的多维数据分析在趋势预测与传播链重构中的应用,亦大幅增强了对耐药菌扩散的感知能力与防控效率。
然而,AI技术的广泛应用仍面临诸多挑战。首先,在数据质量与异构性方面,由于数据集中某些群体(如不同族裔)的代表性不足,导致算法缺乏泛化能力。其次,在算法透明度与可解释性方面,尽管机器学习模型可通过特征重要性提升可解释性,但其内在的复杂关联(如病原体耐药性与抗生素使用量之间的关系)仍难以被完全阐明。最后,在隐私保护及伦理合规风险方面,AI算法可能无意中放大社会偏见。例如,某算法因将医疗费用作为健康需求的替代指标,错误地将黑人患者判定为比患有同样疾病的白人患者更健康,进而影响了治疗优先级的判断[48]。
此外,AI系统的有效临床整合有赖于多学科协同推进及与临床工作流程的无缝嵌合。因此,未来研究应在提升模型泛化能力、加强临床验证、建立标准化数据平台及完善法律伦理框架等方面持续深化。随着技术进步与应用深化,AI有望在未来AMR防控体系中发挥更为核心的作用,推动形成更快速、精准且具有前瞻性的感染管理策略,为全球遏制AMR提供强有力的科技支撑。
(本文编辑:李慧文)
来源: 协和医学杂志


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 协和医学杂志
协和医学杂志 

