现代人的餐桌上,糖、脂肪和蛋白质无处不在,但真正稀缺的,反而是膳食纤维。它几乎不提供能量,却是肠道微生态维持平衡的基础。近期发表在 iMeta 的研究《Linking dietary fiber to human malady through cumulative profiling of microbiota disturbance》提出,膳食纤维的缺乏与一系列疾病之间的联系,正是通过肠道菌群长期累积的紊乱实现的。
这项研究的创新在于提出了“微生物群累积扰动分析(cumulative profiling of microbiota disturbance)”的概念。研究团队综合多队列数据,发现肠道菌群对低纤维饮食的响应并非短期可逆,而是一种“累积性失衡效应”。即便在恢复高纤维摄入后,菌群结构与代谢功能仍可能长期停留在紊乱状态,提示菌群生态具有“代谢记忆”。
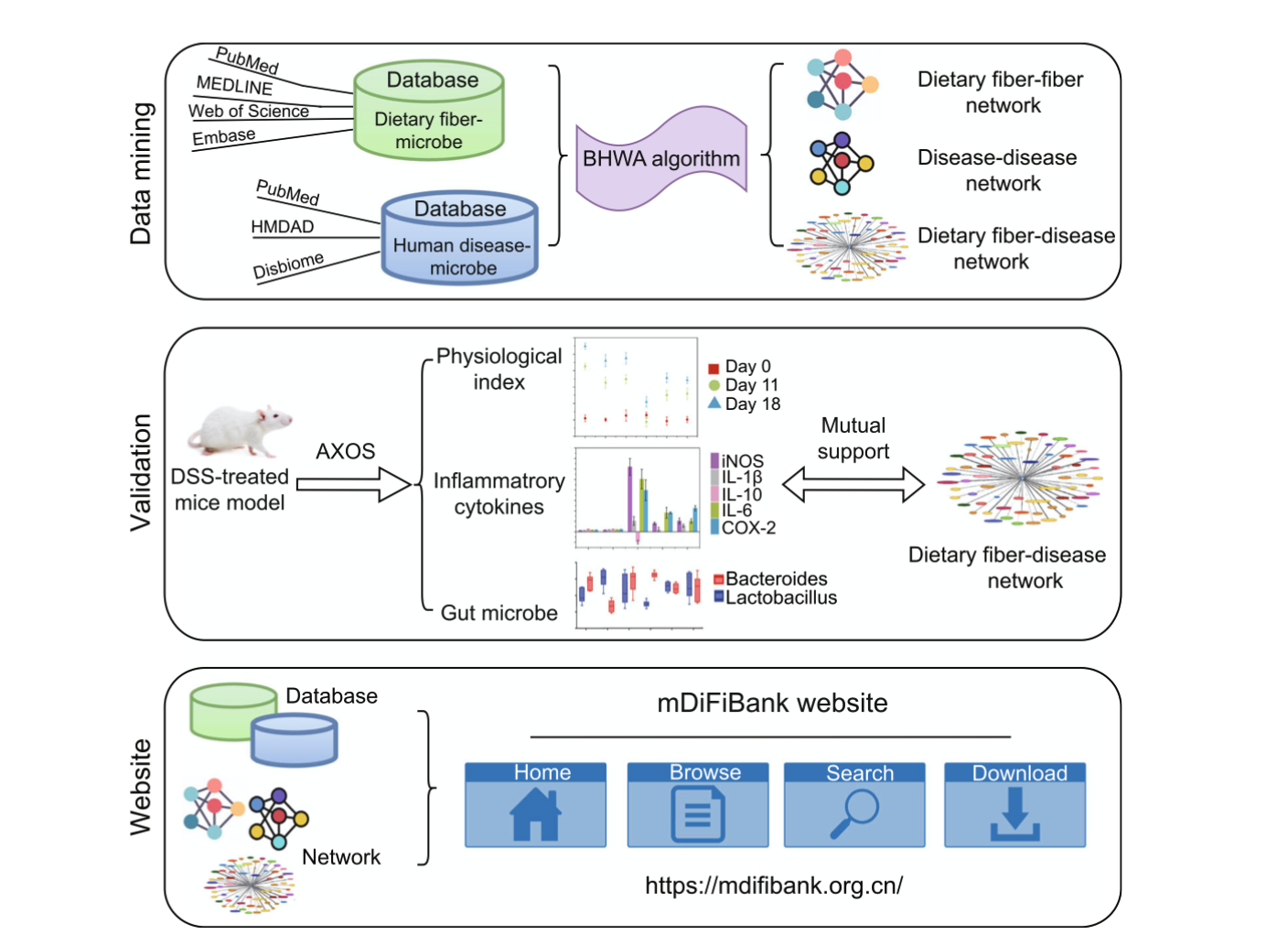
图1|数据库的构建与验证流程图
研究团队通过整合数据挖掘与实验验证,建立了一个可供研究者探索“膳食纤维–肠道微生物–疾病”关系的公共资源。
研究发现,纤维摄入不足会显著降低肠道微生物多样性,尤其影响那些依赖多糖发酵的菌群,如 Faecalibacterium、Roseburia 和 Eubacterium。这些细菌是短链脂肪酸(SCFAs)——尤其是丁酸(butyrate)——的主要生产者。丁酸不仅是结肠上皮细胞的重要能量来源,还能通过调控炎症信号维持免疫稳态。当丁酸减少时,肠屏障能量供应不足,通透性上升,促炎分子可进入血液循环,引发系统性炎症。
在动物模型中,低纤维饮食导致肠道菌群向“蛋白发酵型”转变,氨、硫化氢及苯酚类代谢产物增加。这些代谢物具有细胞毒性,会破坏上皮黏液层,并进一步抑制产丁酸菌的生长,形成恶性循环。研究者指出,这是一种由饮食驱动的自我放大型紊乱:肠道菌群在缺乏纤维的环境中被迫“啃食”宿主的防线。
更令人担忧的是,这种菌群紊乱与多种慢性疾病之间存在显著关联。通过跨疾病分析,研究发现糖尿病、肥胖、炎症性肠病(IBD)乃至抑郁症等多种疾病患者的菌群结构,都呈现出与长期低纤维饮食相似的特征:多样性下降、产丁酸通路受损、炎症相关菌上升。这提示肠道菌群失衡可能是多种疾病的共同“起点”。
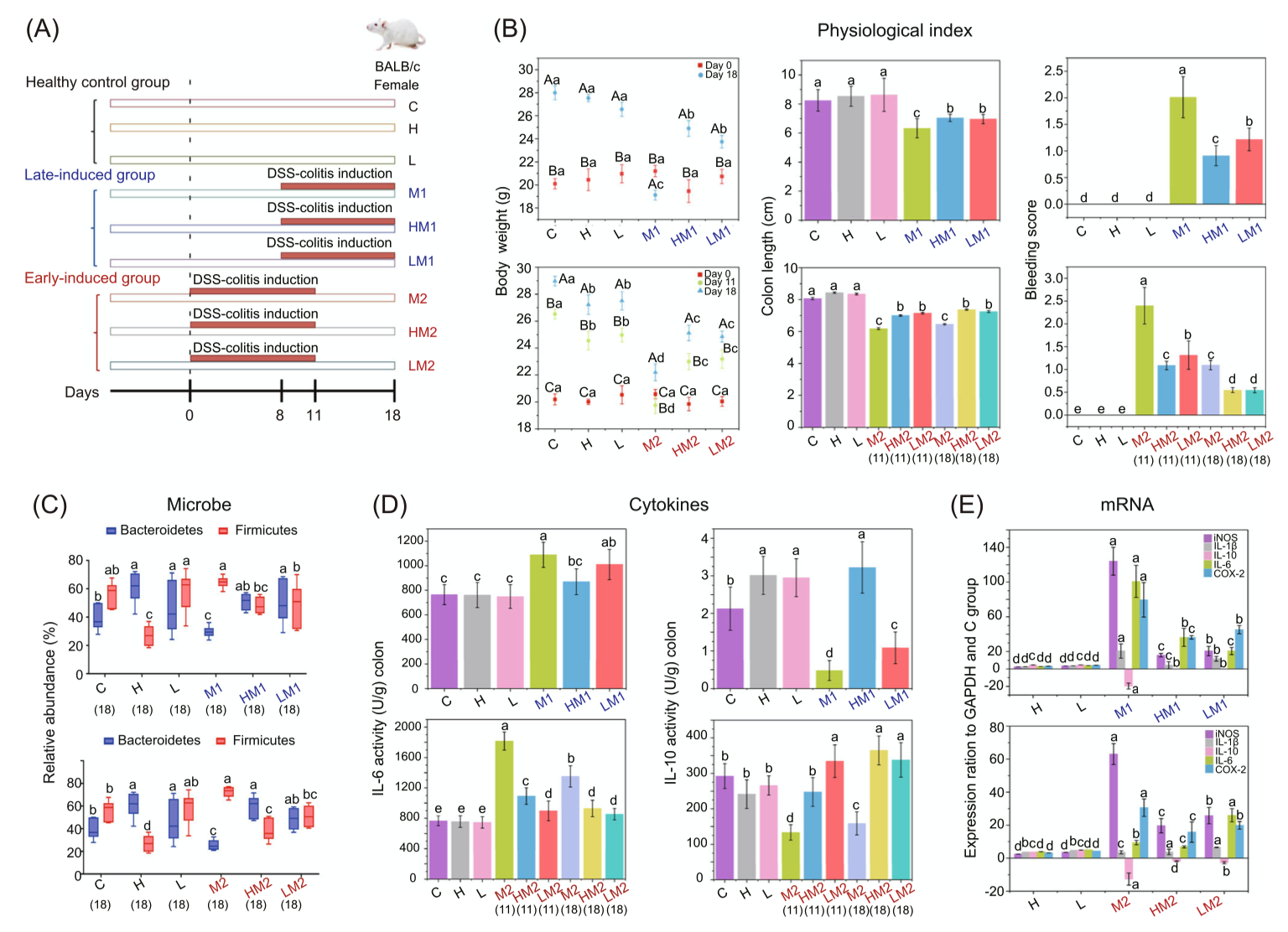
不同疾病共享肠道菌群失衡特征,支持“微生物组–疾病互联网络”假说,为疾病干预提供了系统性视角。
研究团队进一步指出,膳食纤维的保护作用不仅体现在肠道,还影响全身代谢。短链脂肪酸可调节肝脏葡萄糖代谢、脂肪酸氧化与食欲控制;同时通过作用于GPR41/43受体,参与血压调节与胰岛素敏感性维持。缺乏这些信号分子,会削弱能量代谢的自稳系统,使机体更易出现代谢综合征和慢性炎症。
或许最具警示意义的,是研究提出的“生态恢复窗口”概念:当菌群紊乱持续时间过长,部分关键菌群可能永久消失,生态系统进入不可逆简化状态。此时,即使重新补充膳食纤维,也难以恢复原有功能网络。这意味着——健康饮食的补救有其“时间成本”。
这篇研究的结论直指现代饮食文明的核心矛盾:我们获得了前所未有的能量密度,却失去了与微生物共生的平衡。膳食纤维不仅是营养,更是人与菌群之间维系信任的语言。当这种语言被长期沉默,疾病的对话就会开始。
参考文献
Zhang X, Liu H, Li Y, Wen Y, Xu T, Chen C, Hao S, Hu J, Nie S, Gao F, Jia G. Linking dietary fiber to human malady through cumulative profiling of microbiota disturbance. iMeta. 2025. doi:10.1002/imt2.70004
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
