导 读近日,浙江大学茶学系徐平教授团队在国际顶级食品期刊《Food Chemistry》上在线发表了题为“Oxidases and rolling dominate black tea polysaccharide conjugates formation: Enzymatic and non-enzymatic mechanisms”的研究论文。该研究深入探讨了红茶加工过程中茶多糖缀合物(BTPS)的形成机制,特别是酶促和非酶促作用在其中的关键角色。研究团队通过细致分析红茶在萎凋、揉捻和发酵等不同加工阶段中BTPS缀合物的成分和结构变化,发现揉捻过程是BTPS缀合物形成的关键一步。在揉捻过程中,酚类物质和蛋白质含量显著增加,同时糖醛酸和中性糖含量减少,这表明揉捻促进了这些组分之间的相互结合。进一步的体外酶促反应实验揭示,氧化酶在缀合物形成中起着主导作用,尤其是过氧化物酶(POD)在多酚氧化酶(PPO)的协同作用下,通过酶促氧化途径显著促进了缀合物的形成。这一发现改变了以往认为发酵是红茶中多酚氧化主要阶段的传统观念,强调了揉捻时期酶促反应对缀合物形成的决定性影响。为了探究分子层面的相互作用,研究团队还采用了分子对接技术,揭示了蛋白质、酚类和糖链单元之间通过氢键和疏水作用形成的强烈联系。其中,LEU-189、ARG-458和HIS-145等关键氨基酸残基被识别为在这些相互作用中发挥着重要作用。这些分子机制解析为理解BTPS缀合物的结构稳定性提供了重要的理论基础。研究结果总结出BTPS缀合物的形成涉及三大主要途径:酚类在氧化酶作用下形成邻醌,并与蛋白质和多糖共价结合;酚类、蛋白质和多糖通过氢键和疏水力进行非共价相互作用;以及酚类氧化形成茶黄素等衍生物,再与蛋白质和多糖相互作用。此项研究深入阐明了红茶多糖缀合物形成的酶促和非酶促机制,为红茶加工工艺的优化提供了科学依据。通过精准调控揉捻参数和酶促反应条件,有望设计出具有特定结构和功能特性的BTPS缀合物,从而提升红茶的健康益处和感官品质。
英 文 摘 要
Tea processing significantly contributes to the heterogeneity of tea polysaccharide conjugates; however, the specific mechanisms underlying their formation remain unclear. In the present work, it is found that rolling is the critical stage for the formation of black tea polysaccharide conjugates. In vitro enzymatic reactions demonstrated that oxidases, particularly peroxidase with synergistic support from polyphenol oxidase, mediate conjugate formation. Molecular docking studies further revealed strong interactions between proteins, phenolics, and sugar chain units through hydrogen bonding and hydrophobic forces, with key residues such as LEU-189, ARG-458, and HIS-145 playing pivotal roles. This study elucidates the enzymatic and non-enzymatic mechanisms underlying black tea polysaccharide conjugate formation and provides novel insights for optimizing tea processing to precisely design polysaccharide conjugates.
代表性图片
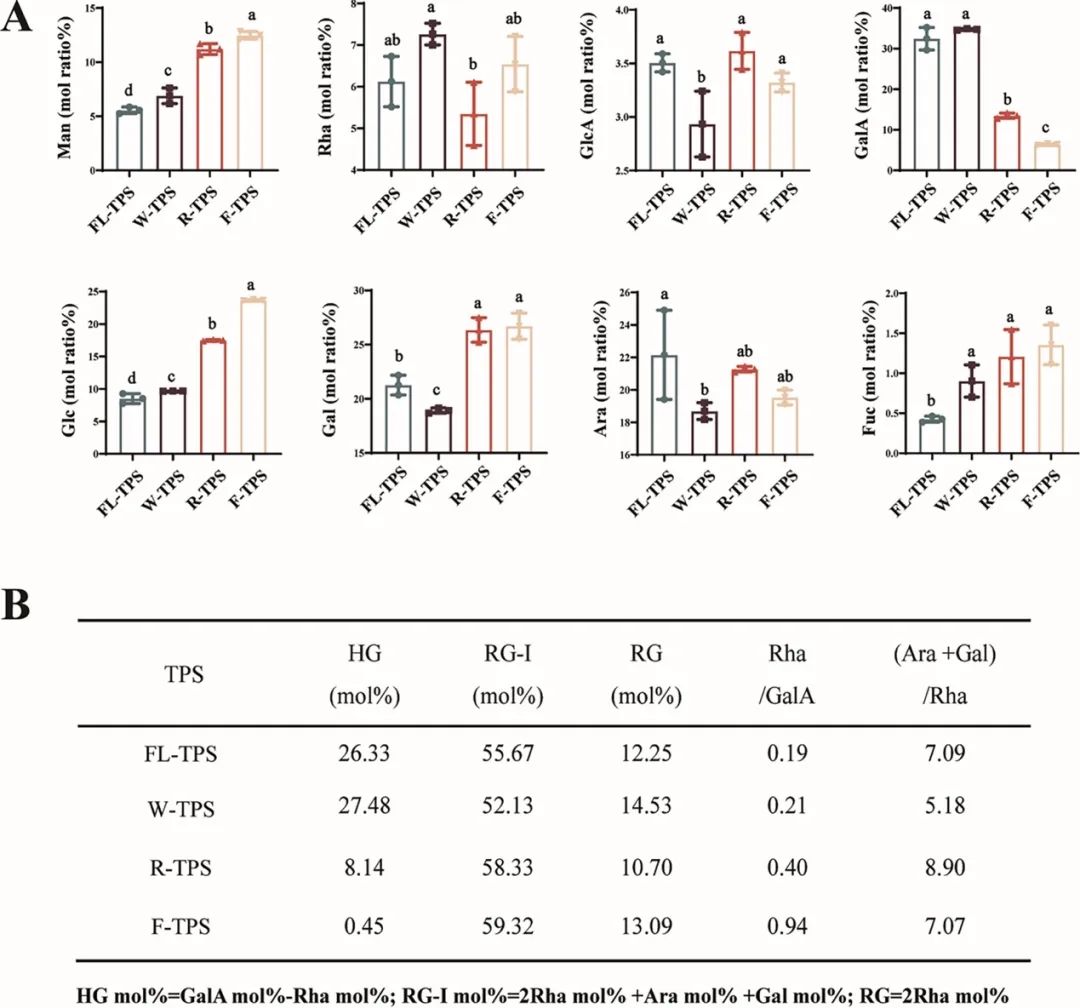
图1. BTPS缀合物在加工过程中成分的动态变化。(A) 单糖组成; (B) 区域。数据表示为平均值 ± 标准差(误差线所示;n = 3)。不同字母表示根据Duncan和LSD检验(P RG-I mol%=2鼠李糖 (Rha) mol% +阿拉伯糖 (Ara) mol% +半乳糖 (Gal) mol%;RG=2鼠李糖 (Rha) mol%
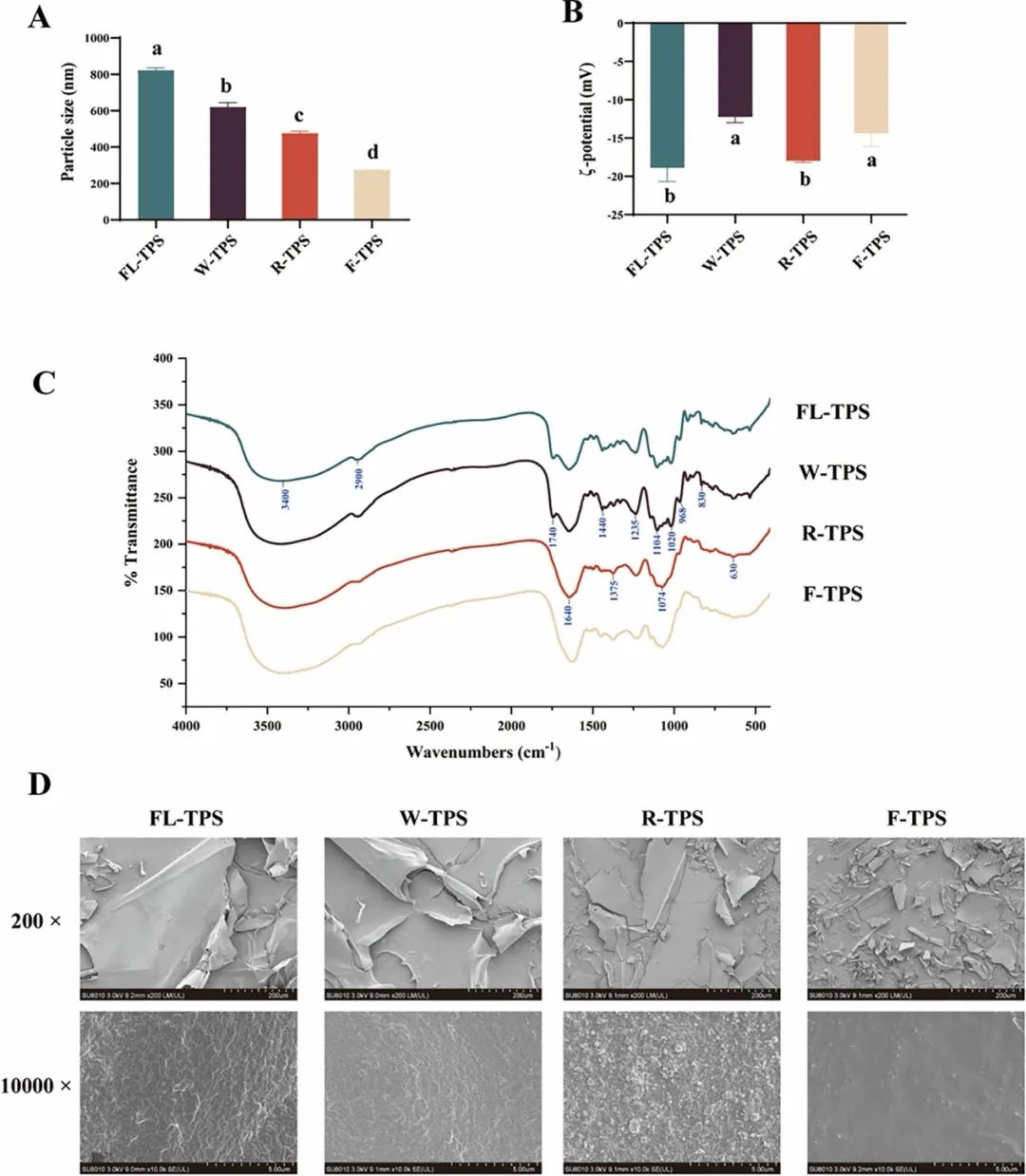
图2. BTPS缀合物在加工阶段的结构变化。(A) 粒径; (B) ζ-电位; (C) FT-IR光谱; (D) SEM图像。数据表示为平均值 ± 标准差(误差线所示;n = 3)。不同字母表示根据Duncan和LSD检验(P
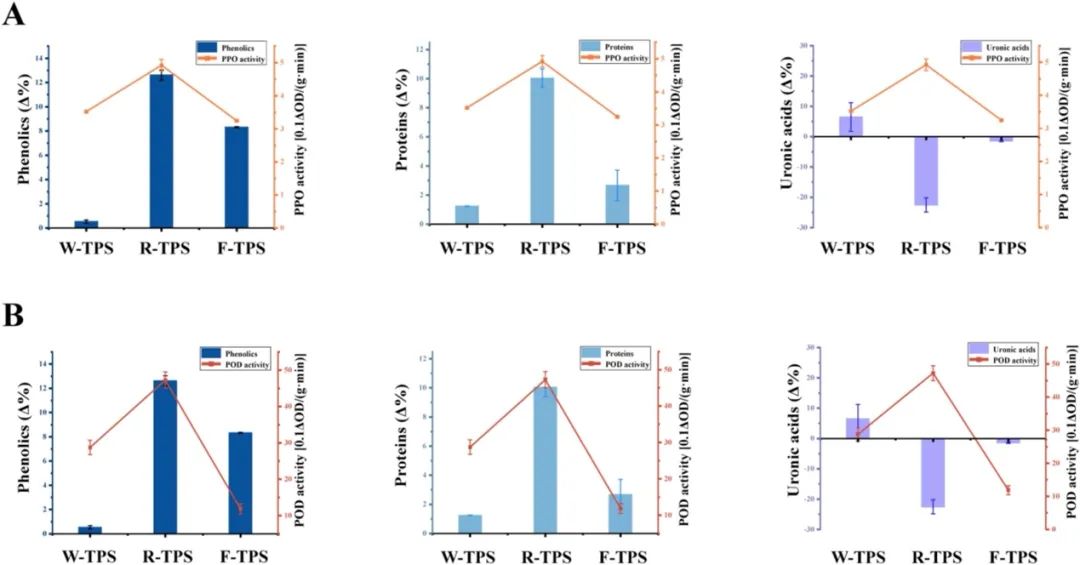
图3. BTPS缀合物组成与氧化酶活性之间的相关性。(A) PPO;(B) POD。数据表示为平均值 ± 标准差(误差线所示;n = 3)。不同字母表示根据Duncan和LSD检验(P < 0.05)的单向方差分析,差异显著。
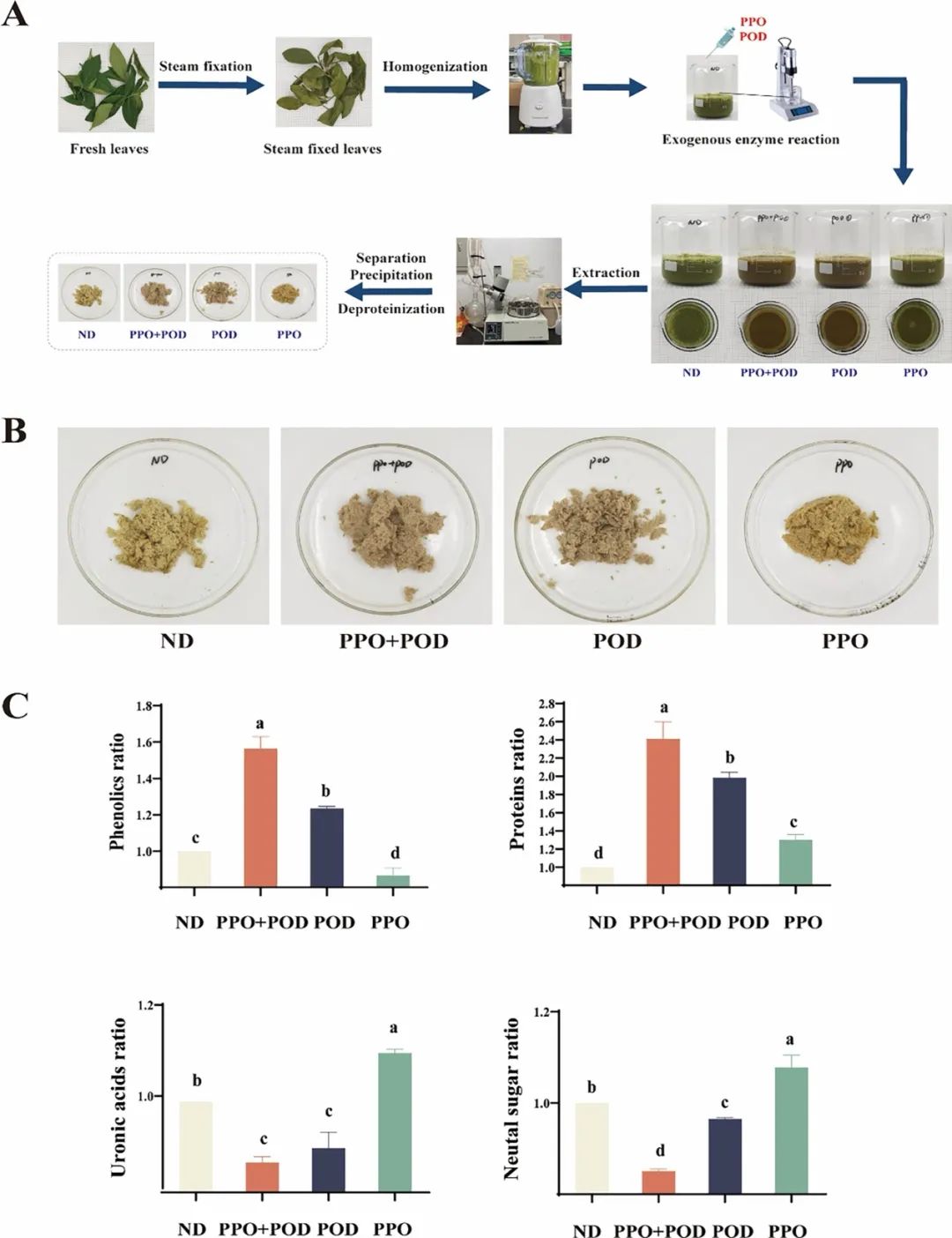
图4. BTPS缀合物形成中的酶促调控。(A) 体外固定化茶叶酶促反应示意图;(B) 表观形态图;(C) 多糖缀合物的组成。数据表示为平均值 ± 标准差(误差线所示;n = 3)。不同字母表示根据Duncan和LSD检验(P < 0.05)的单向方差分析,差异显著。
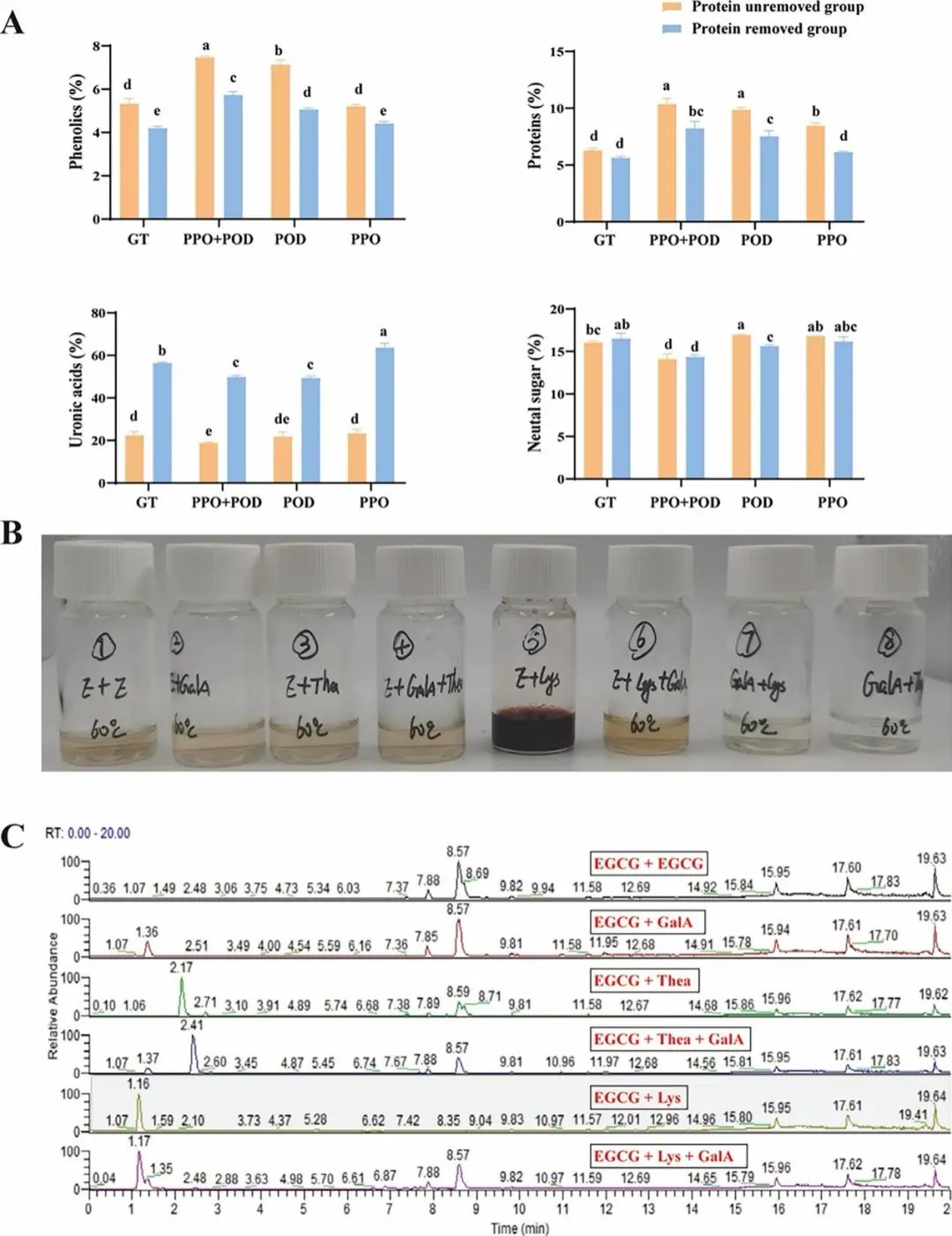
图5. BTPS缀合物形成的小分子模拟测试。(A) 小分子模拟测试前后的BTPS缀合物组分;(B) 小分子模拟测试的表观形态图;(C) 不同小分子模拟测试中BTPS缀合物的组成。数据表示为平均值 ± 标准差(误差线所示;n = 3)。不同字母表示根据Duncan和LSD检验(P
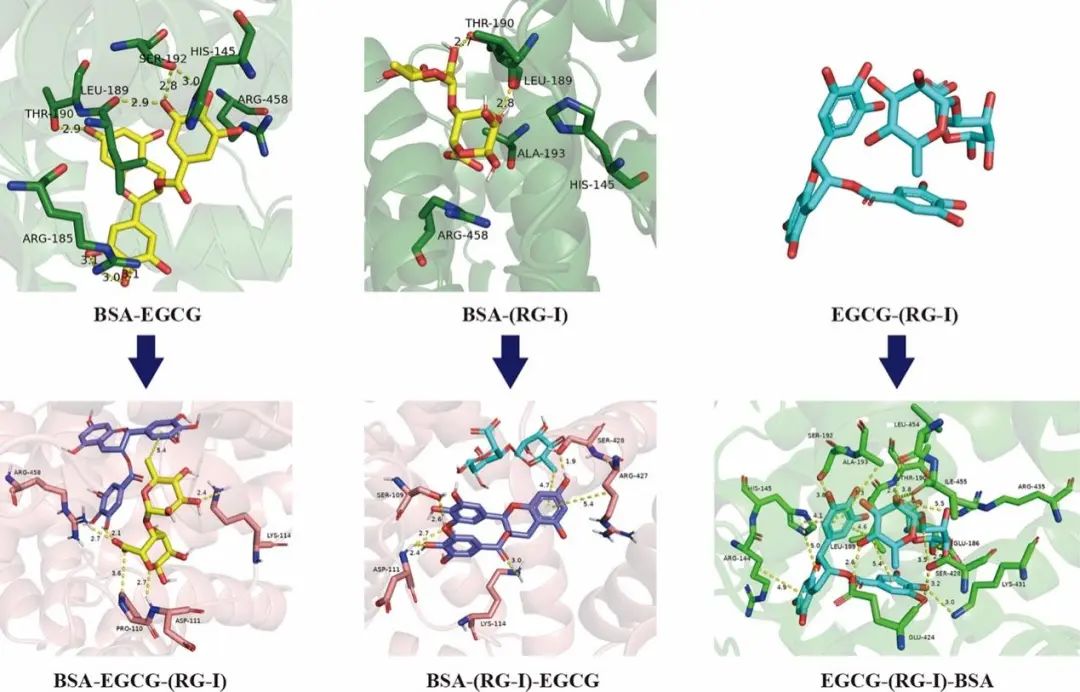
图6. EGCG、RG-I和BSA的非共价相互作用。氢键用黄色虚线表示,并标记键长。
作者:浙江省农业科学院 徐安安、浙江大学茶叶研究所 陈琳
审稿:安徽农业大学 张梁 教授
来源: 中国茶叶学会
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 中国茶叶学会
中国茶叶学会 
