在纽约洛克菲勒大学的一间实验室里,科学家们做了这样一个大胆的实验,他们将一种名为 NOVA1 的人类语言相关基因的变体导入小鼠体内。这个变体其实只涉及一个氨基酸分子改动——第197位氨基酸由异亮氨酸换成了缬氨酸,但它是现代人类与尼安德特人之间的重要遗传差异之一。研究团队好奇,这个在人类语言进化中被自然选择留下的“微小突变”,究竟是否藏着我们语言能力的某种秘密。
结果让人惊讶。带有这个人类版本基因的小鼠,从小的叫声就变得不同,音调更高,节奏也更复杂。等它们长大后,雄性在追求配偶时甚至“唱”出了比普通小鼠更复杂的情歌。
它们并没有突然获得语言能力,但显然,它们说话的方式已经变了。这是一种接近语言边界的尝试——用遗传学手段,去触碰人类最独特的能力之一:说话。
NOVA1:一种“语言感”的遗传密码
在复杂的人类语言背后,是否存在某种基因编码?科学家长期试图解答这个问题。人类之所以能够进行抽象思维、使用语法、表达情绪,很大程度上依赖于大脑中复杂的神经回路与精密的调控机制。而这背后,正是基因在悄悄指挥一切。
在众多语言候选基因中,一个名叫 NOVA1 的基因引起了科学家的高度关注。它是一种 RNA 结合蛋白,主要在中枢神经系统中表达,参与调控神经元中的基因剪辑过程——即可变剪接。简单来说,它像一位“编辑师”,决定哪些基因片段被拼接进最终的蛋白产物中,从而影响神经元的功能与连接模式。
特别有意思的是,NOVA1 的第197个氨基酸位点,在现代人类与尼安德特人之间存在一个关键差异,我们是缬氨酸(Valine, V),他们是异亮氨酸(Isoleucine, I)。别小看这仅仅一个氨基酸的变化——在超高保守的 NOVA1 蛋白中,它位于核心结构域(KH2)内,是 RNA 识别和结合的关键区域。而且,这个变体在全球人类群体中几乎固定存在,提示它可能在远古时期经历了强烈的自然选择压力。
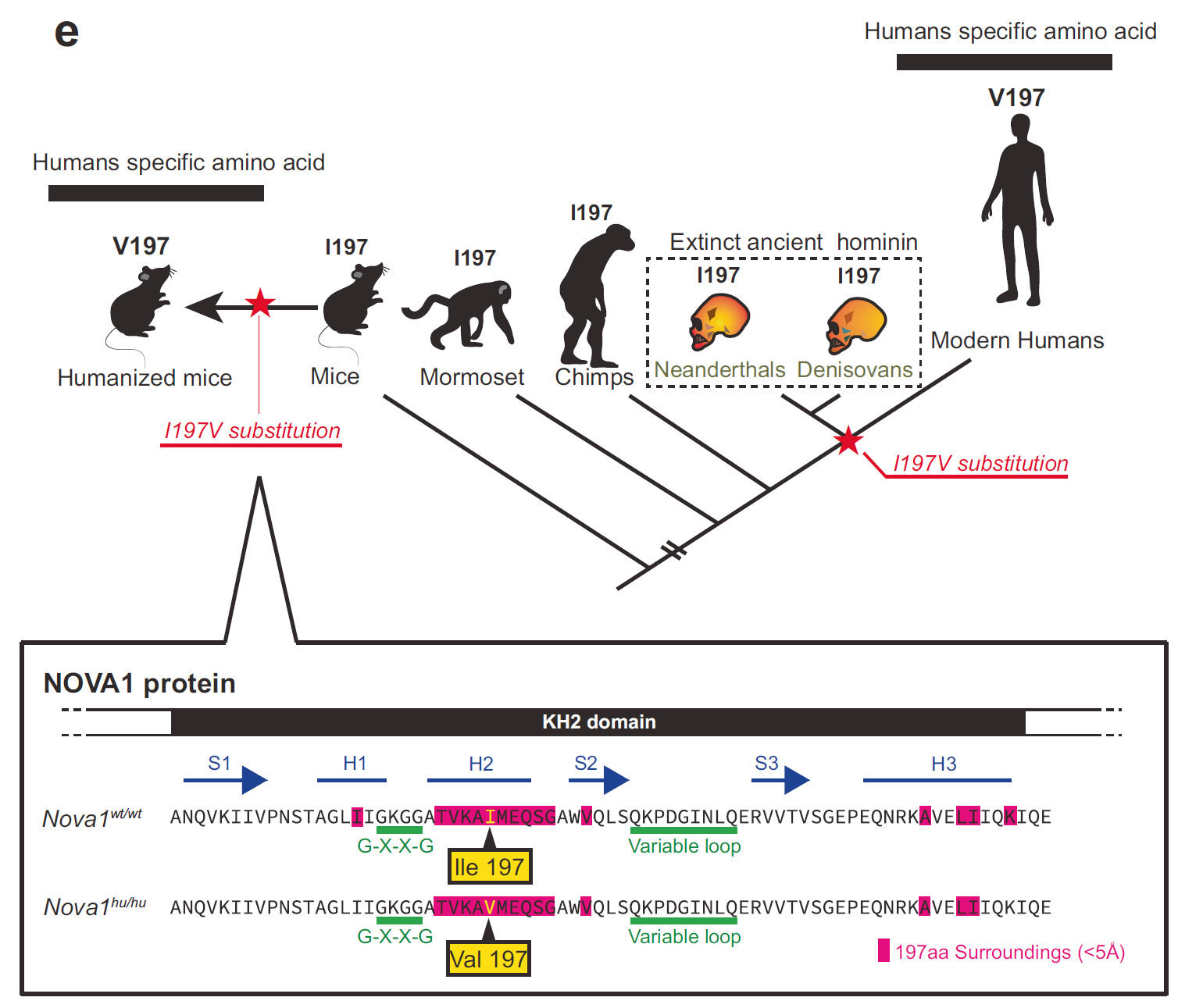
NOVA1基因第197个氨基酸变化的进化时间模型(图片来源:参考文献[1])
进化基因组学分析表明,这种 NOVA1 的人类特有版本(I197V)可能出现在20万年前非洲的某一支现代智人祖先中,后来随这群人类扩散到全世界,成为现代人共同的遗传特征之一。而尼安德特人、丹尼索瓦人等表亲们则没有这种突变。这一细节令人浮想联翩——难道是这个微小的分子差异,让我们的祖先在语言能力上迈出了一步?
值得一提的是,NOVA1 不只是一个语言相关的遗传因素,它还与神经发育疾病有关。一些携带 NOVA1 缺失突变的人类患者,往往表现出语言迟缓、多动和社交障碍等症状。而在小鼠中,删除 NOVA1 基因则会导致出生后因运动功能异常快速死亡,说明它对神经系统功能至关重要。
不过,光有这些线索还远远不够。为了验证 NOVA1 的这个微小突变是否真的影响语言相关的功能,科学家们决定做一件更直接的事,把它移植进老鼠体内,然后看看会发生什么。
老鼠也能“说得更复杂”?
在这项研究中,科学家利用基因编辑技术将人类特有的 NOVA1 变体(I197V)引入小鼠体内,生成了“人源化”小鼠。这些小鼠在生长发育和脑结构上与普通小鼠无异,但当它们开口说话时,却展现出了明显不同的特征。
研究团队发现,刚出生几天的“人源化”小鼠在与母鼠分离时发出的超声波叫声与普通小鼠相比,在频率、音调结构和节奏上都更为复杂。它们发出的音节不仅音调更高,且常带有更多变化,例如音高跳跃和多重音段。这类变化虽然我们肉眼难察,但通过声音频谱图分析,可清晰看出其“语言结构”更为丰富。
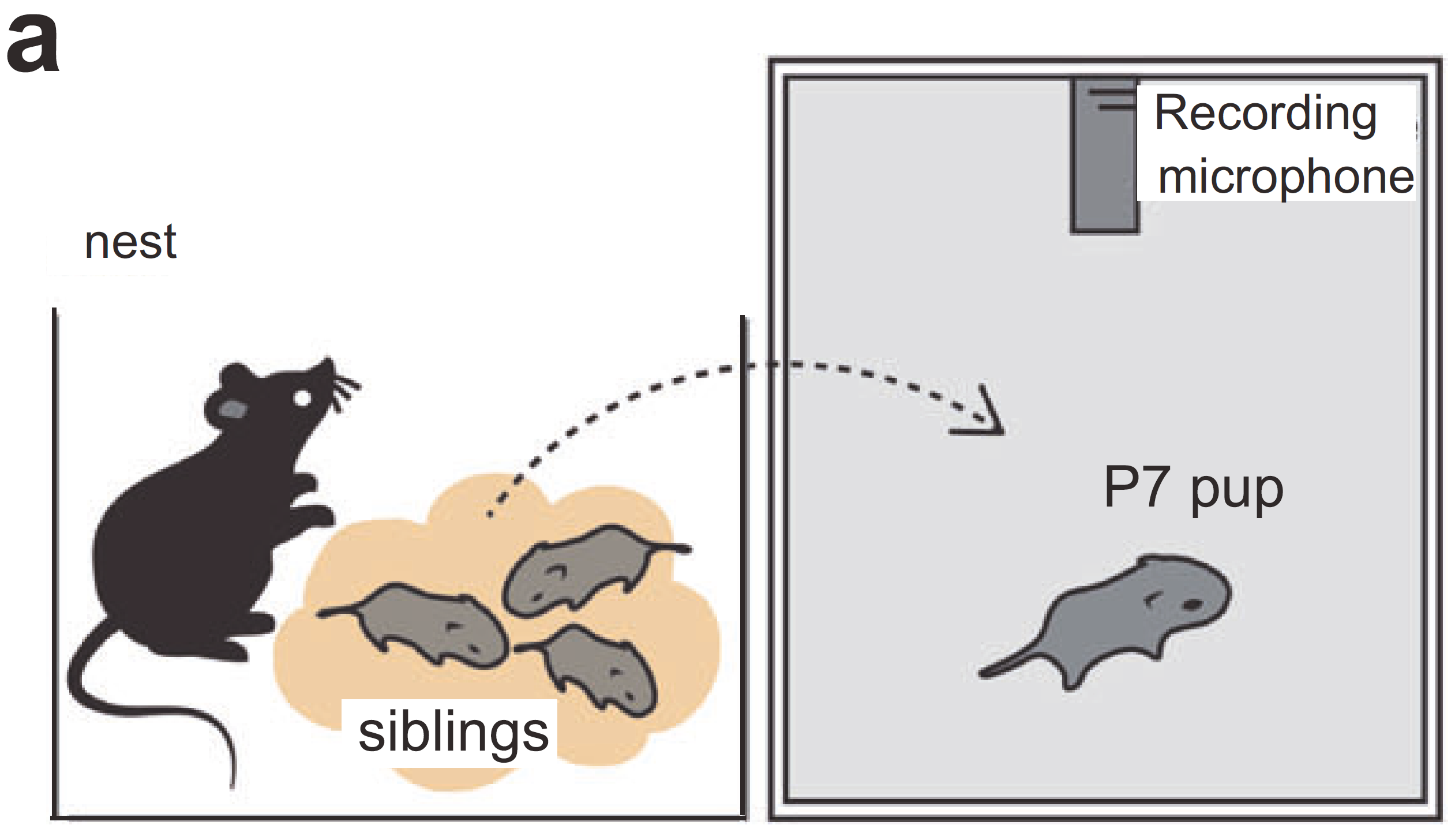
幼崽的隔离诱导超声波发声 (USV) 测试(图片来源:参考文献[1])
成年雄鼠的表现更加明显。在求偶实验中,这种小鼠发出的叫声拥有更高的最大频率、更多跳跃音调和更复杂的节奏。这些被认为是老鼠情歌的信号,在自然环境中可能增强其吸引配偶的能力。尽管母鼠在行为测试中对这些声音没有表现出显著偏好,但声音本身的变化已经证明,仅一个氨基酸的改变,就足以调控发声模式的精细差异。
从分子机制看,研究表明这些发声差异与大脑中特定区域的基因剪接变化有关,尤其集中在中脑导水管周围灰质等控制先天发声的神经区域。研究还发现,多个与发声行为密切相关的基因在这些“人源化”小鼠中发生了剪接变异,其中包括已知与语言障碍、神经发育和自闭症相关的基因如 Auts2 和 Nrxn2。这些发现提示我们,语言能力的演化或许正是通过一系列微妙但关键的分子调控,逐步塑造出更复杂的表达潜能。
总结
人类语言的起源,或许远比我们想象的复杂,也更微妙。它不是单一基因的产物,而是千百个调控因子的协同结果。但这项研究提醒我们,有些看似微不足道的遗传变异,可能正是那个转折点——让我们从简单的叫喊走向复杂的表达。语言不是一蹴而就的奇迹,而是一场缓慢而坚定的进化。
参考文献:
[1] Tajima Y, Vargas C D M, Ito K, et al. A humanized NOVA1 splicing factor alters mouse vocal communications[J]. Nature Communications, 16.1 (2025): 1542.
[2] Chabout, Jonathan, et al. "A Foxp2 mutation implicated in human speech deficits alters sequencing of ultrasonic vocalizations in adult male mice." Frontiers in behavioral neuroscience 10 (2016): 197.
[3] Meyer, Matthias, et al. "A high-coverage genome sequence from an archaic Denisovan individual." Science 338.6104 (2012): 222-226.
[4]Jarvis, Erich D. "Evolution of vocal learning and spoken language." Science 366.6461 (2019): 50-54. [5]
作者丨邵文亚博士 福建医科大学副教授;杨超 博士
审核丨赵宝锋博士 辽宁生命科学学会
来源: 科普中国创作培育计划
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 科普中国创作培育计划
科普中国创作培育计划 
