文章来源:“BTIT俱乐部”公众号

随着岁月的流逝,我们的肌肉逐渐失去了年轻时的活力,这一现象被称为肌肉老化。它不仅影响着我们的运动能力,还与多种慢性疾病(如2型糖尿病),有着密切的联系。肌肉,在全身代谢调节中扮演着核心角色,尤其是在葡萄糖代谢方面。
尽管科学家们仍在积极探索肌肉老化如何影响代谢功能这一复杂问题,但最新的研究成果已经开始揭示过程中的关键分子——甘油磷酰胆碱二酯酶1(Gpcpd1)。这种在肌肉组织中高度表达的酶,负责分解甘油磷酰胆碱(GPC),在维持葡萄糖代谢平衡中扮演着至关重要的角色。
近期,《Nature Aging》发表了一篇关于肌肉老化及其对葡萄糖耐受性影响的深入研究Gpcpd1–GPC metabolic pathway is dysfunctional in aging and its deficiency severely perturbs glucose metabolism,为我们理解肌肉老化背后的生物学机制提供了新的视角。
相关研究回顾
肌肉老化与多种分子和代谢紊乱紧密相关,这些紊乱可能会影响肌肉功能和全身代谢。例如,Demontis等人(2013)的研究已经表明,随着年龄的增长,肌肉对葡萄糖的利用能力显著下降,这可能导致全身葡萄糖代谢的紊乱(Demontis, F., et al., 2013)。此外,Chia等人(2018)的研究发现,这种代谢能力下降与年龄增长有关,进一步强调了肌肉老化对葡萄糖代谢的影响(Chia, C. W., et al., 2018)。
在分子层面上,Houtkooper等人(2011)的研究表明,GPC作为Gpcpd1酶的底物,在老化小鼠肌肉中的含量显著升高,这可能与肌肉老化过程中的代谢变化有关(Houtkooper, R. H., et al., 2011)。此外,Pilling等人(2016)的研究揭示了人类GPCPD1基因附近的单核苷酸多态性(SNP)与长寿之间的关联,这为理解Gpcpd1在人类健康和寿命中的作用提供了新的线索(Pilling, L. C., et al., 2016)。这些研究结果为本文提供了坚实的理论基础,促使研究者们进一步探索Gpcpd1在肌肉老化中的作用,尤其是在葡萄糖代谢调控方面的影响。
Gpcpd1酶在衰老过程中的变化
研究团队首先在小鼠模型中观察了Gpcpd1 mRNA表达和GPC代谢物水平随年龄的变化。他们发现,与年轻小鼠(6个月大)相比,老年小鼠(24个月大)的骨骼肌中Gpcpd1 mRNA水平显著下降,导致GPC在肌肉中积累。这表明其在肌肉老化和代谢功能下降中起到关键作用。
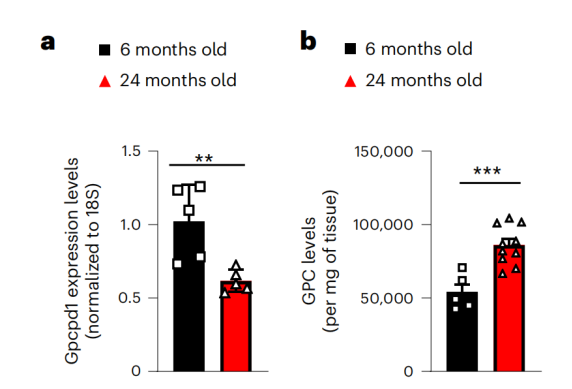
老年小鼠骨骼肌中Gpcpd1 mRNA水平下降、GPC积累显著为了研究Gpcpd1缺乏背后的生理效应,研究者们创建了几个组织特异性的Gpcpd1缺乏小鼠模型,包括肌肉、肝脏或脂肪组织。通过葡萄糖耐受性测试、胰岛素信号传导分析、转录组分析和脂质组学分析,进一步评估Gpcpd1缺乏对小鼠代谢的影响。
研究发现,在肌肉特异性Gpcpd1基因敲除(即缺乏Gpcpd1)的小鼠中,当它们被喂食高糖或高脂饮食时,其体内葡萄糖耐受性会进一步恶化。这表明Gpcpd1在肌肉中对维持正常的葡萄糖代谢起着重要作用,而其缺乏会加剧饮食引起的代谢问题。
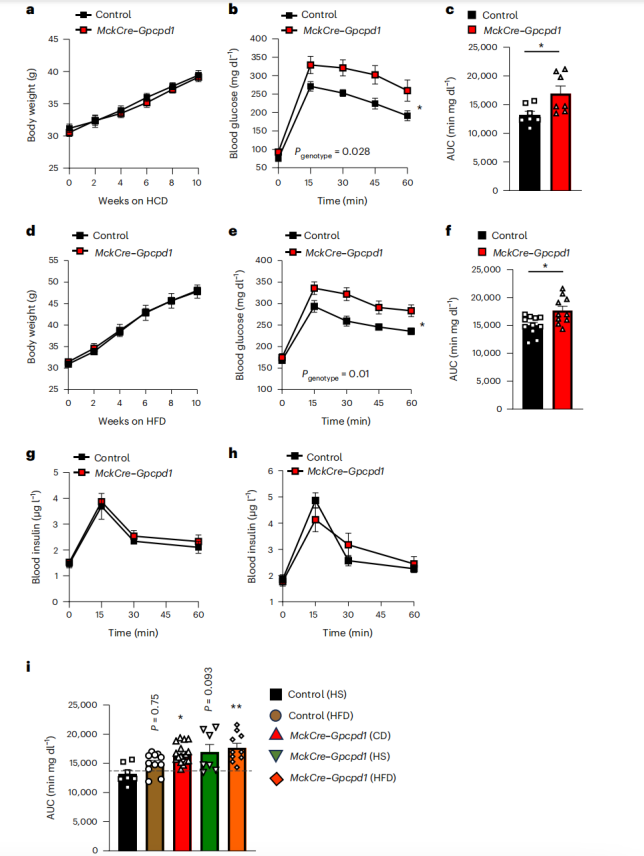
上图共同揭示了肌肉特异性Gpcpd1缺乏小鼠在高糖和高脂饮食条件下的葡萄糖耐受性受损情况更为关键的是,两项独立的成年人研究(年龄在44至70岁之间)揭示了一个显著的趋势:随着年龄的增长,肌肉中的Gpcpd1 mRNA表达水平显著下降,这暗示了Gpcpd1酶活性的减弱。与此同时,久坐不动的老年人肌肉中GPC及其磷酸二酯衍生物的水平出现了相应的上升。此外,与非糖尿病患者相比,2型糖尿病患者的骨骼肌中GPC及其磷酸二酯衍生物的积累更为显著。
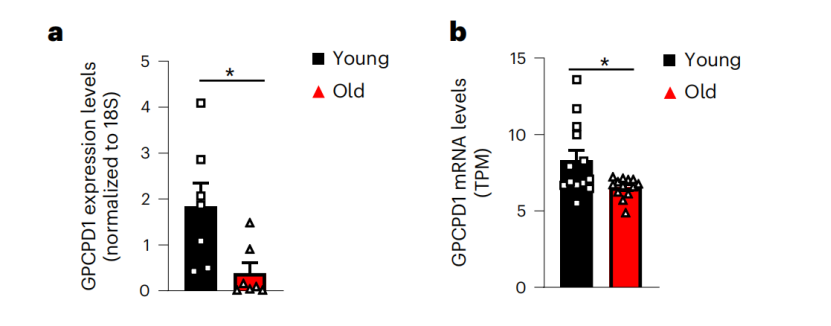
两个独立成年人队列中,肌肉GPCPD1 mRNA水平随年龄的变化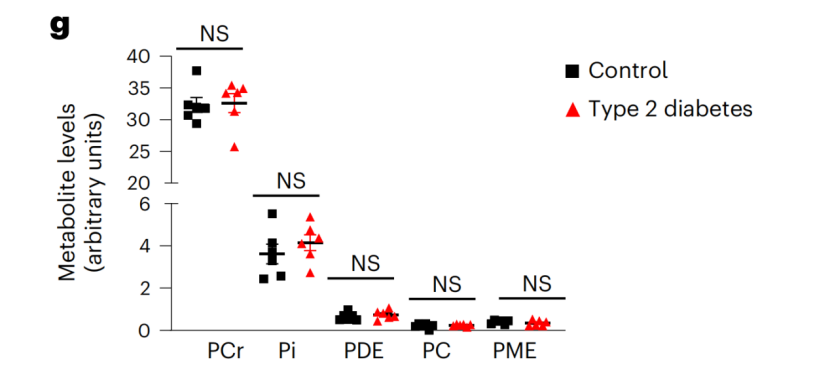
健康志愿者和2型糖尿病患者的肌肉GPC和GPC-磷酸二酯水平对比Gpcpd1作为抗衰老的潜在靶点
研究认为,Gpcpd1-GPC代谢途径在调节葡萄糖稳态中起着重要作用,并且在衰老过程中,这一途径的功能可能会受损。这表明Gpcpd1可能是一个潜在的抗衰老治疗靶点。
文章的通讯作者Josef M. Penninger院士是奥地利科学院院士,欧洲科学院院士,世界领先的医学科学家之一,已经做出了多项突破性的研究成果,并开发了可以使数百万患者受益的新药。Josef M. Penninger院士指出:“我们的研究揭示了肌肉组织中甘油磷酰胆碱(GPC)降解途径在老化过程中的关键作用,并强调了健康干预措施,如运动或间歇性禁食,对这一途径的潜在影响。” 他进一步表示:“我们的长期目标是开发针对这些已识别途径的治疗策略,以改善老年人的葡萄糖代谢,并预防和治疗2型糖尿病等与老化相关的代谢疾病。”Penninger教授及其团队的这一突破性研究,无疑为老化研究领域带来了新的希望,并为未来的健康干预策略提供了强有力的科学支持。
参考资料
[1] Cikes D, Leutner M, Cronin SJF, Novatchkova M, Pfleger L, Klepochová R, Lair B, Lac M, Bergoglio C, Viguerie N, Dürnberger G, Roitinger E, Grivej M, Rullman E, Gustafsson T, Hagelkruys A, Tavernier G, Bourlier V, Knauf C, Krebs M, Kautzky-Willer A, Moro C, Krssak M, Orthofer M, Penninger JM. Gpcpd1-GPC metabolic pathway is dysfunctional in aging and its deficiency severely perturbs glucose metabolism. Nat Aging. 2024 Jan;4(1):80-94. doi: 10.1038/s43587-023-00551-6. Epub 2024 Jan 18. PMID: 38238601.
[2] Demontis F, Piccirillo R, Goldberg AL, Perrimon N. Mechanisms of skeletal muscle aging: insights from Drosophila and mammalian models. Dis Model Mech. 2013 May;6(5):1339-52. doi: 10.1242/dmm.010244. Epub 2013 Apr 22. PMID: 23375909.
[3] Chia CW, Egan JM, Ferrucci L. Age-related changes in glucose metabolism, hyperglycemia, and cardiovascular risk. Circ Res. 2018 Aug 3;123(3):886-904. doi: 10.1161/CIRCRESAHA.118.312439. Epub 2018 Jun 21. PMID: 30309759.
[4] Houtkooper RH, et al. The metabolic footprint of aging in mice. Sci Rep. 2011;1:134. doi: 10.1038/srep00134. Epub 2011 Apr 21. PMID: 22190332.
[5] Pilling LC, et al. Human longevity is influenced by many genetic variants: evidence from 75,000 UK Biobank participants. Aging (Albany NY). 2016 Jun;8(6):547-60. doi: 10.18632/aging.100962. Epub 2016 Apr 28. PMID: 27176760.
撰文:小鱼
审核:淑霞
排版:楚涵
来源: BTIT俱乐部


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 BTIT俱乐部
BTIT俱乐部 
