中山大学附属第一医院&中科大先进院等研究团队,提出了一种深度学习模型——图信号处理-图卷积网络 (GSP-GCNs),利用从涉及声调调节的特定任务中获得的事件相关脑电图数据来诊断帕金森病。
震颤、动作迟缓、表情僵硬……提起帕金森病,多数人会率先想到「手抖」,殊不知,在患病中晚期,患者甚至还会出现平衡障碍、翻身困难等问题,下肢、头部都会不自主地抖,严重影响生活质量。
中国康复医学会于 2023 年 4 月发布的数据显示,我国现有帕金森病患者 300 多万,超过全世界总数的四分之一,并且每年新增加约 10 万,预计到 2030 年,我国帕金森病患者总数将达到 500 万人,几乎达到全球患病人数的一半。
然而目前帕金森病的发病机制尚未可知,仅 20% 的病例可归因于特定的遗传因素,因此早期诊断面临重大挑战。
静息态脑电 (electroencephalogram,EEG) 因其无创性以及捕捉高时序分辨率脑活动的能力,已成为帕金森病诊断的重要途径。近年来,已经有相关研究开始将深度学习与 EEG 结合,进行帕金森病的早期诊断。然而,这些方法大多需要基于平稳的 EEG 信号才能奏效,无法捕捉帕金森病相关脑活动变化的动态特征。
针对于此,中国科学院深圳先进技术研究院和中山大学附属第一医院的研究人员,利用帕金森病言语运动任务的异常脑电特征,提出了一种具有可解释性的图信号处理-图卷积网络 (GSP-GCNs) 模型,利用言语基频调控任务脑电数据,通过挖掘帕金森病患者大尺度脑功能网络的神经标记物,实现了帕金森病的高精度智能诊断。
获取论文:
https://www.nature.com/articles/s41746-023-00983-9
公众号后台回复「帕金森」获取完整 PDF
数据集:百位参与者的发声实验
研究团队邀请到了 100 名参与者,其中包括 52 名被诊断为特发性帕金森病的患者(24 名女性和 28 名男性),和 48 名与患者性别、年龄相匹配的健康对照。所有参与者都进行了发声实验。
在实验过程中,参与者需要持续发出元音 5-6 秒,持续时间为 200 毫秒。每次发声包括 4-5 次扰动,以伪随机方式呈现。参与者连续发声 20-25 次,共进行 100 次试验。
当参与者进行发声实验时,研究人员使用 NetStation 软件,以 1kHz 的采样频率,使用连接到 Net Amps 300 放大器 (EGI) 的 64 导联电极帽来记录 EEG 信号。
GSP-GCNs模型:由4个连续组件组成
GSP-GCNs 模型框架包括 4 个模块:图信号处理模块 (GSP)、图网络模块 (graph-network module)、分类器 (classifier) 和可解释模型 ( interpretable model)。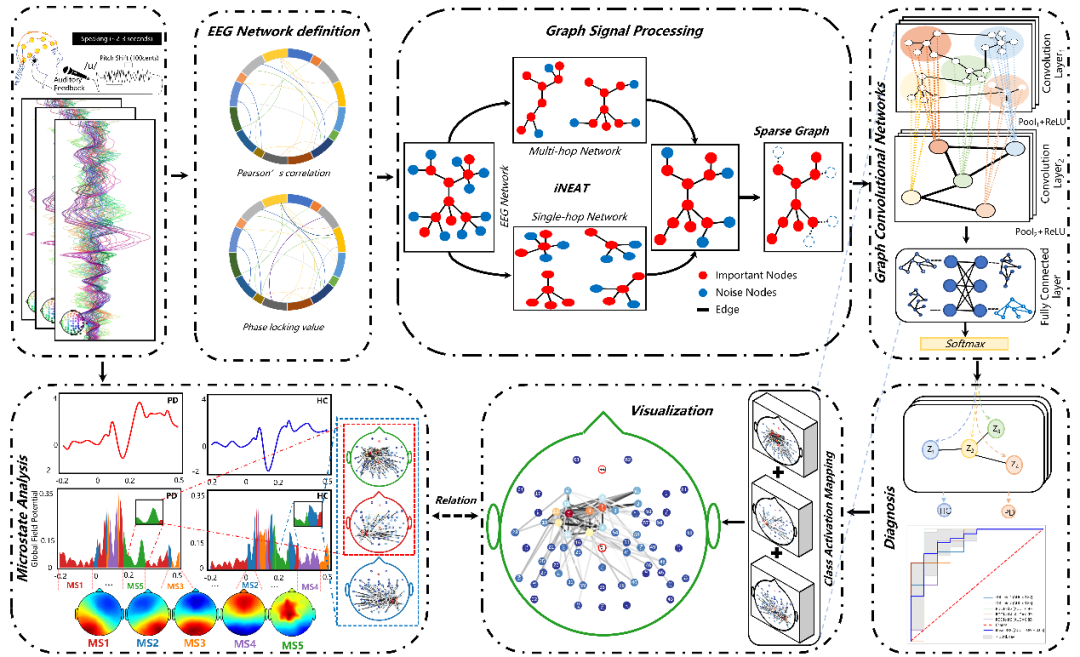
* 首先,GSP 模块对大规模 EEG 网络进行分析和处理,识别动态连接模式;
* 其次,图网络模块捕获这些连接模式作为分类的关键特征;
* 随后,分类器组件利用这些提取的特征来区分帕金森病患者和健康个体;
* 最后,可解释性模型通过提供全局可视化学习基本特征,并将其与语音相关的 EEG 微态特征对齐,来增强框架的可解释性。
通过采用这种创新方法,GSP-GCNs 框架旨在提供说明性信息,以促进深度学习模型在具有任务相关 EEG 数据的帕金森病诊断中的使用。
模型效果:具有较好的解释性
该研究提出了四个基于图网络的模型: PCC + GCN、 PLV + GCN、 PCC + GSP-GCN 和 PLV + GSP-GCN。
其中,PCC (Pearson Correlation Coefficient)、PLV (Phase Locking Value) 分别代表用于构建脑网络的不同特征。然而,无论特征类型如何,GSP-GCNs 模型都表现出明显优于 GCNs 模型的性能。
如下图所示,该研究所提出的 GSP-GCN 模型的 ROC 值均保持在 0.08 以下。这凸显了 GSP 通过图聚合平衡单跳和多跳网络的局部和全局信息,从而提高分类性能的潜力。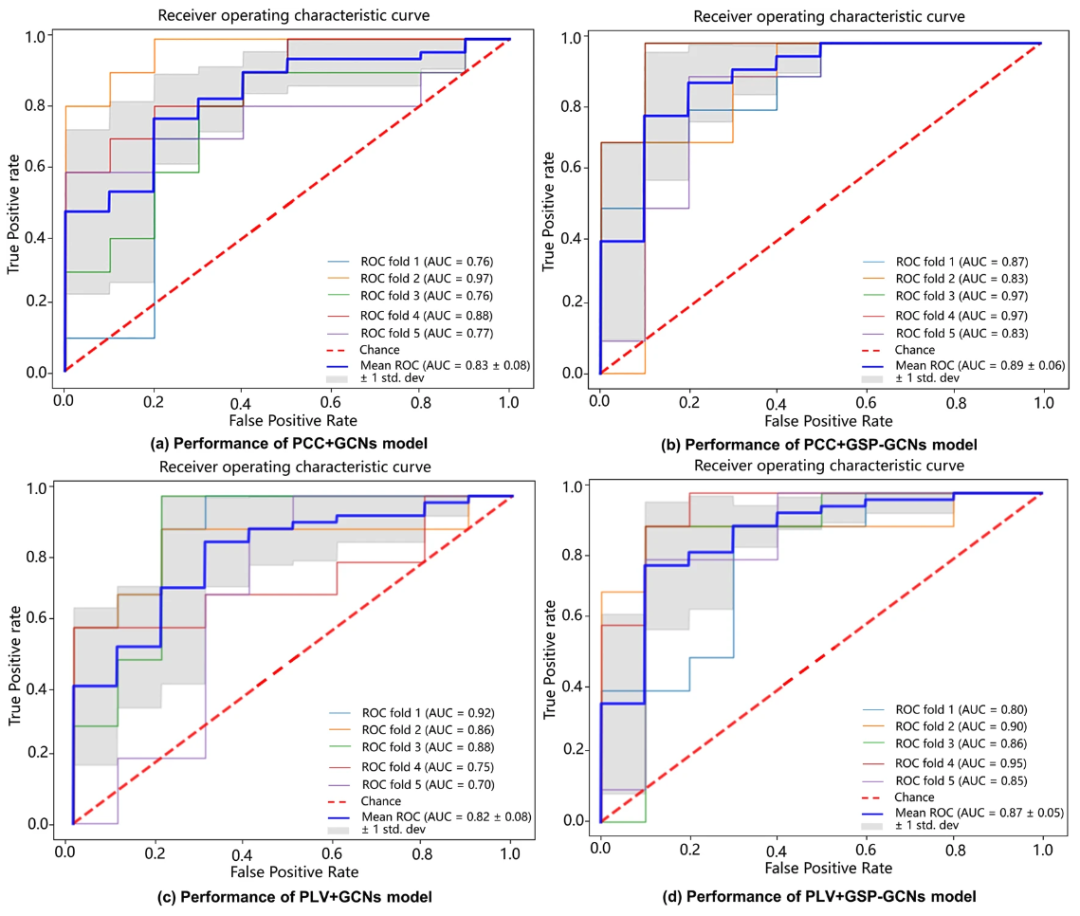
通过结合局部和全局信息,该研究提出的 GSP-GCNs 模型区分帕金森病患者与正常对照的平均分类准确率达 90.2%,比其他深度学习模型显著提高 9.5%。此外,GCNs 模型显示出比所有基线模型 (baseline models) 更低的计算复杂度。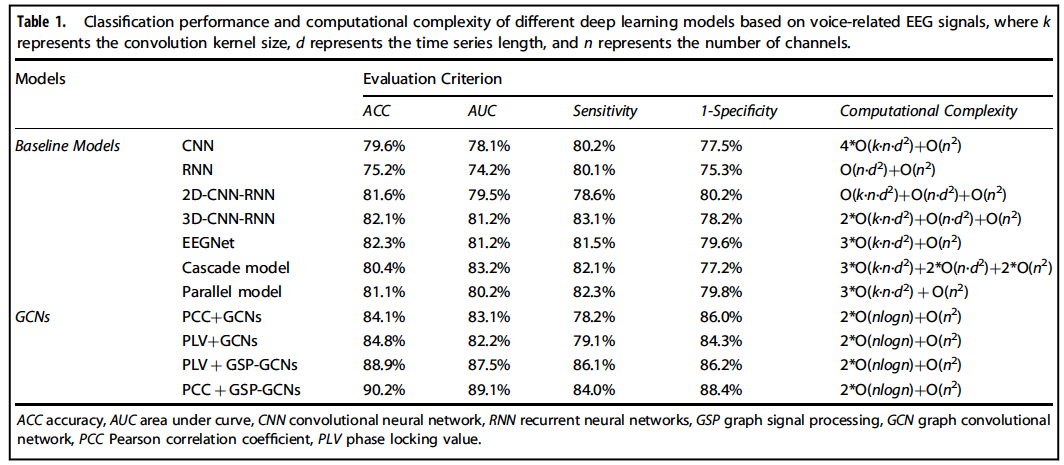
GSP-GCNs 模型与其他模型
分类性能、计算复杂度对比
此外,研究团队通过分析 GSP-GCNs 模型的可解释性,揭示了其对大尺度脑电图网络和 MS5 微状态脑电地形图之间差异分布的学习结果。帕金森患者与正常对照在言语基频调控任务中,存在显著差异的脑区主要位于的左腹前运动皮层、颞上回和 Broca 区域,这与既往发现的帕金森病言语运动障碍脑网络存在高度一致性。
这说明,该研究提出的 GSP-GCN 模型能够从大规模网络中识别出独特的脑电图生物标志物,并提供了良好的可解释性。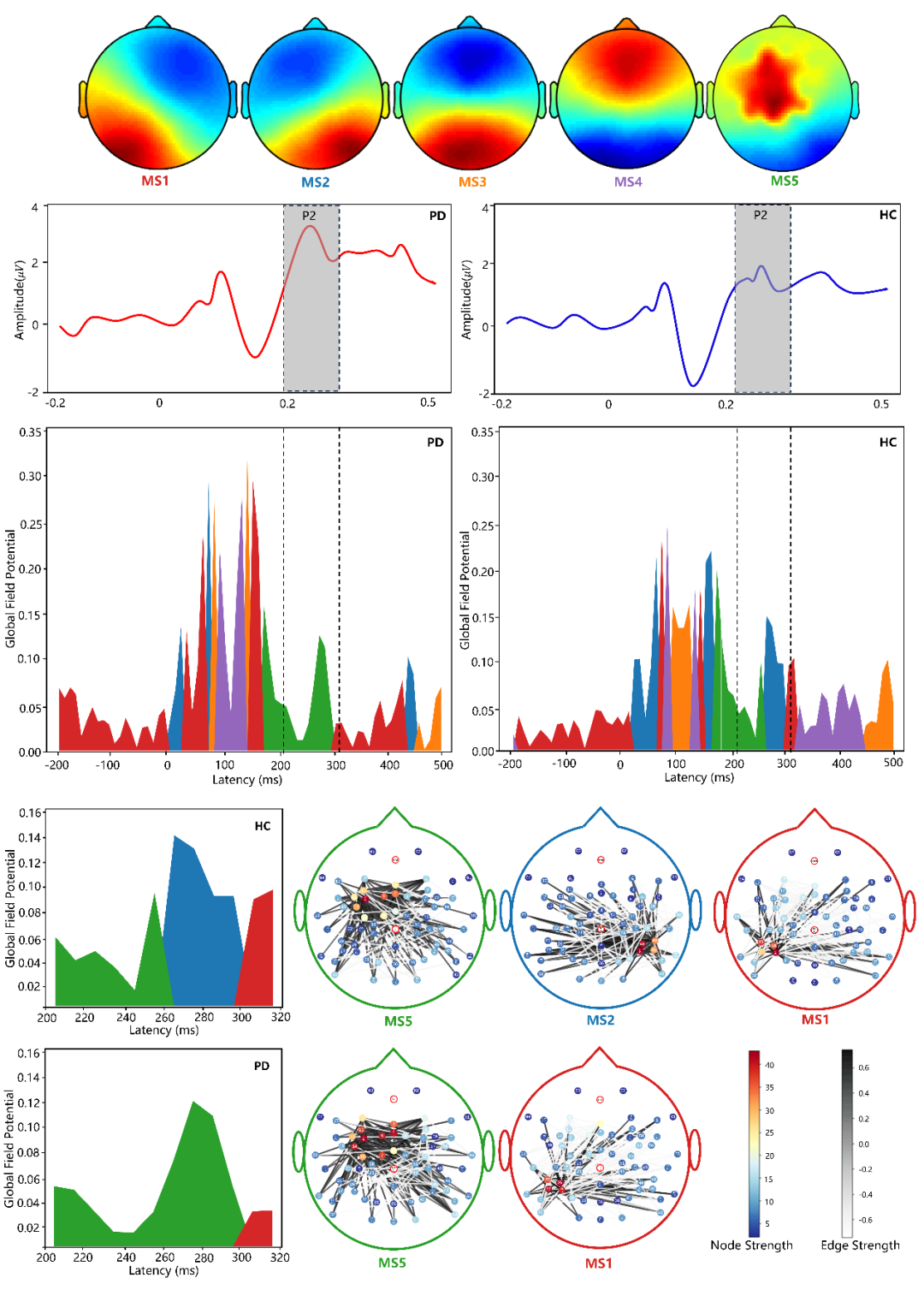
帕金森病组和正常对照组在言语运动任务中的
ERP 微状态类分布对比
(右上角标注PD为帕金森病组,HC为正常对照组)
更重要的是,该模型可以有效学习帕金森病患者和正常对照组在听觉反馈任务中脑功能网络之间的差异,为分析深度学习应用于疾病诊断分类模型的可解释性提供了新方法。
AI识别生物标志物,助力帕金森病诊断
帕金森病起病隐匿,进展缓慢,尽早诊断、及时干预,对提高疗效极为重要。而帕金森病早期诊断的重要途径在于识别各种行为领域的生物标志物,包括笔迹模式、运动功能、步态模式和语言特征等。
机器学习近年来已成为医学影像领域的一个强大工具,这项技术有助于从复杂的神经成像数据中提取高级特征和模式。此外,由于其卓越的多维分析能力,机器学习还可用于医学影像领域的个体分类。本次中山附医联合研究团队所提出的 GSP-GCNs 模型便是通过挖掘帕金森病患者语言相关的的神经标记物实现诊断,而 AI 深度学习模型运用于帕金森病各种行为领域方面的识别,还有十分可观的发展空间。
与之类似,福建医科大学附属协和医院研究团队近期开发了一种机器学习模型,预测帕金森病患者在个体水平上患冻结步态的风险,可用于早期识别有可能发展成延迟冻结步态的帕金森病患者,从而为临床医生预防和干预帕金森病患者的冻结步态症状提供有价值的指导。
此外,University College London (UCL) 的研究团队使用 300 名帕金森病患者和 300 名健康志愿者的视频数据训练了人工智能算法,使其能够识别帕金森病患者的运动模式,在诊断帕金森病方面的准确率高达 90%。
在未来,期待基于神经成像学的机器学习 AI 能进一步被运用,帮助人们有效识别帕金森病症状相关的各种行为领域的生物标志物,从而推动帕金森病早期诊断的进一步发展。
来源: HyperAI超神经


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 HyperAI超神经
HyperAI超神经 
