看过《众病之王》的亲们,你们看后有什么想法呢?有没有这样一种感觉——癌症之所以不可破是因为TA比人类进化得更完美?
作为一名生物学博士,我的研究领域是长寿,但是我也在做癌症。我们发现长寿和癌症有不少重叠,所以可以认为,长寿和癌症,在某一方面上有共同的地方(未发表数据)。今天就来和大家聊聊癌症和长寿有哪些重叠?
01,人为什么会衰老?
我们知道,随着年龄的增加,人的细胞会变得衰老。原因包括:
1,基因突变的积累
2,细胞损伤的积累
3,代谢废物的积累
4,端粒缩短
其实简单的理解,就像一辆汽车老化一样,各个部件都会出现问题,线粒体出问题,高尔基体出问题,内质网出问题,反正一大堆。
那么,我们能否清除这种衰老的细胞呢?
02,衰老细胞能否被清除?
能否清除衰老细胞?理论上是可以的。还记得2002年和2016年诺奖么?一个颁发给了程序性死亡 (programmed cell death,PCD) ,一个颁发给了自噬 (autophagy) 。
大隅良典为什么能独得 2016 年诺贝尔生理学或医学奖?他在细胞生物学研究上做出了哪些突出贡献?

程序性死亡
这就是人体的主要清除机制,在这两种手段之下,人体会对那些受损的或者衰老的细胞进行清理,从而维持细胞的状态。
事实上,我们的确可以看到这种情况,比如我们每天的皮肤会有大量的细胞死亡,形成一层层的死皮。
然而,现实是残酷的。这种细胞清理过程,其实更科学的说法是“更新”。什么是更新,那就是用新的去替换旧的。
然而,问题来了?新的细胞从哪里来?也许有人说,我们有干细胞啊,人体内存在大量的干细胞,他们可以弥补我们细胞的缺失,所以我们不至于掉头发掉的最后光头(脱发是病,得治)。
干细胞
然而,很残酷的是,我们的干细胞也会衰老!是的,当随着年龄增加,干细胞变得没那么干练了,甚至,他们变得失去了干性或者消失了……
关于干细胞衰老的理论我们到目前为止尚没有合理的解释,然而,这种现象是客观存在的。
否则如果老年人拥有像婴儿般一样的干细胞的话,只要不得病,那长命百岁是小case,突破永生都不是问题,哪里坏了修复哪里即可。
03,癌症和长寿共享
癌症和长寿在很多内容上共享一些共同的内容。虽然我们知道干细胞随着年龄衰老,然而,我们发现有一种特殊的群体,我们称之为“健康长寿”。这个群体特殊之处在于,他们和正常的衰老不一样,是真的不一样。
这个群体一般是100岁以上,虽然我们曾经认为,人的衰老是渐进的,然而放到群体研究里,却发现一个奇特的现象,100岁的老人是一个特殊的群体,他们总体会呈现一种新的趋势。而这个百岁群体,他们会表现出一种现象,他们很多指标非常的年轻,比如他们的血液各种生化指标大概和70/80岁的人比较类似,而且体内不少的物质很活跃。

我举个例子,之前有篇发表在nature biotechnology 上的文章,他们用不同年龄来源的血细胞诱导出来干细胞,结果发现,百岁老人明显特殊。
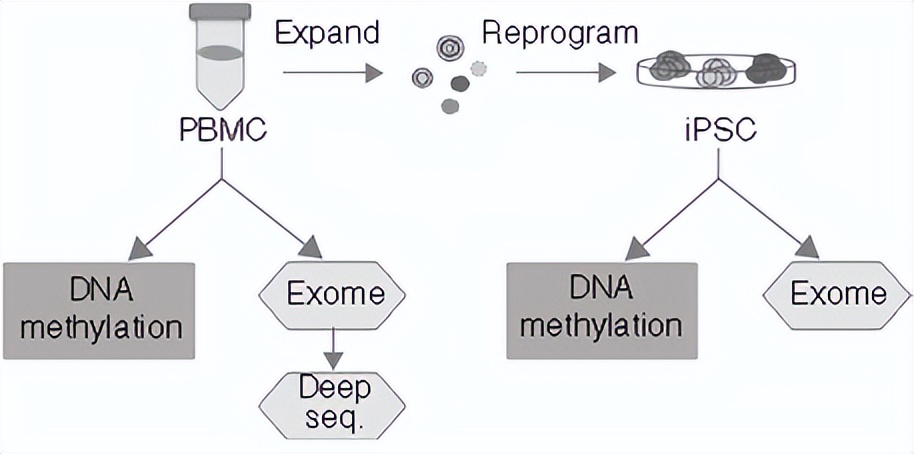
实验设计思路,就是诱导细胞后做外显子组和甲基化组检测来比较干细胞
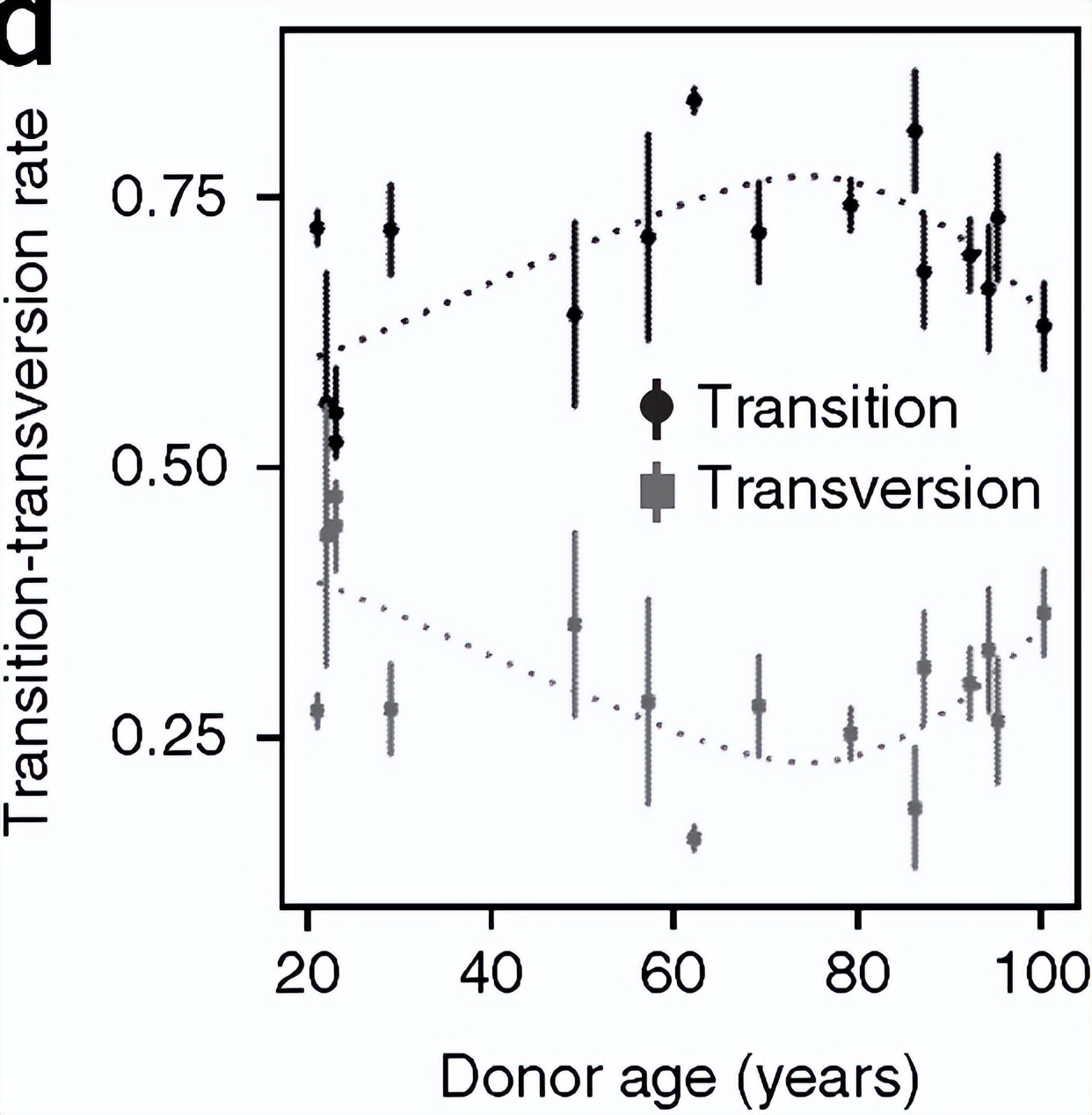
90岁以上transition小于transversion,呈现一个明显的激烈变化。
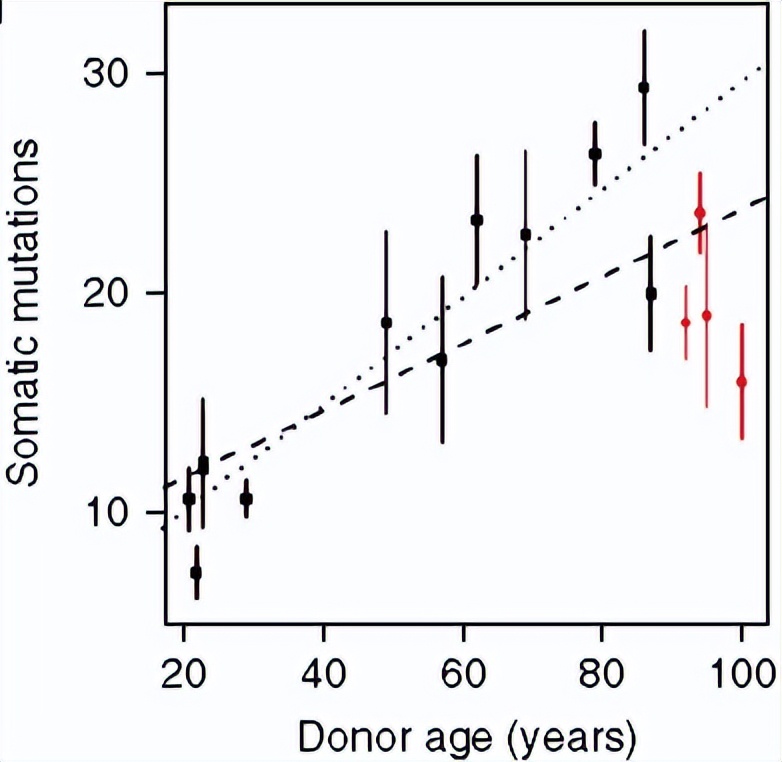
这是突变的分布,请注意红线那些群体,他们是90岁以上的群体,呈现了一个下降的趋势。
04,关于癌症
事实上,癌症的发育过程,是一个总体细胞重新编程的过程。而这个过程,我们发现,很多年轻或者幼年时候才应该出现的东西,在癌症中重新出现或者增加了。
比如大家体检的时候,经常会有个肿瘤标记物甲胎蛋白( AFP ),甲胎蛋白是一种糖蛋白,它是一个分化的指标。因为胎儿的肝尚未完全发育,所以会大量的分化,因此,体内会高度存在。随着肝脏发育完全,这个蛋白合成就很少了。
甲胎蛋白检测流程
然而对于肝癌患者,这个指标又出现了,因为肝癌组织开始重新启动了合成分化过程,于是大量的合成甲胎蛋白。
据不完全统计:在成人,AFP可以在大约80%的肝癌患者血清中升高。事实上,不仅这个指标,癌症中很多指标都会增高,而这些指标大部分和细胞的分裂分化有关,意味着癌组织在快速增长,而这些指标,事实上,另一种意义上,是“年轻指标”。
再比如著名的端粒酶,相信很多人对这个耳熟能详, 2009年度诺贝尔生理学或医学奖授予Elizabeth Blackburn, Carol Greider和Jack Szostak,他们的重要贡献就是对端粒酶的研究。
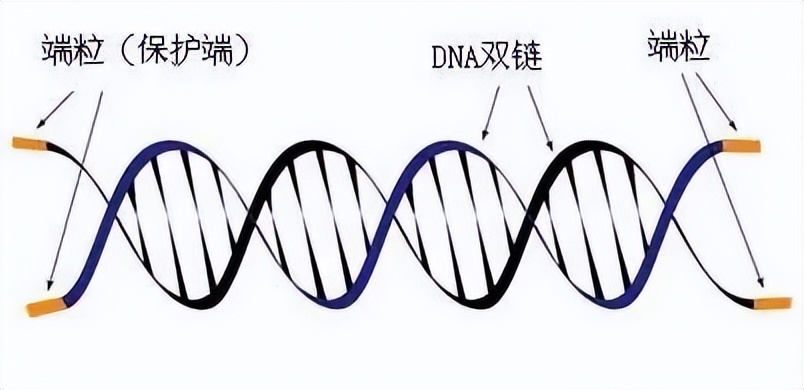
端粒也被科学家称作“生命时钟”。我们知道细胞随着分裂,端粒会逐步缩短,当缩短到一定程度的时候,细胞就会启动程序性死亡。当端粒不能再缩短时,细胞就无法继续分裂而死亡。
端粒酶,则可以修复端粒,让细胞不死。

然而,正常人,这个端粒酶是没有活性的。但是在癌症中,这个酶被激活了,大约90%的癌细胞都有着不断增长的端粒及相对来说数量较多的端粒酶。所以癌细胞可以无限复制而不走向凋亡。
所以想修复端粒的人,先考虑下致癌吧。不过,这个酶,在干细胞中,也是有活性的,在胎儿里也是很多,否则干细胞分裂几次,就得死了。
事实上,长寿和癌症,共享了很多类似的内容,这就比较神奇了。
我们认为,理论上,那些能够获得长寿的人,他们本身各种指标较为年轻,而这种年轻的背后,是那些和年轻有关的各种蛋白在发挥作用,进一步,是那些基因在发挥作用。
比如,某些清除能力很强的基因,某些抵抗演化压力很强的基因,某些维持干细胞很强的基因。甚至,对端粒本身的维护。当然,这些内容,还在研究中,但是,对这一点,我还是比较有信心的。
05,为什么同时做长寿和癌症
长寿是我的主体方向,所以写了不少相关的内容。然而研究长寿的手段却很有限,因为长寿样本有限!
我经常看到有人说,咦,你们的样本怎么性比不平衡,我就一笑而过,你以为长寿满地都有?本来就是女比男多很多。还有人觉得长寿的样本数量太少,其实这些人犯了一些基本的错误,他们看了太多的人口数据,总以为人群中长寿很多,其实,这个比例是非常少的。
由于样本有限,使得我们不得不寻求其他的途径去研究长寿。那就是,寻找如何实现长寿。其实办法很简单:长寿的秘诀就是不得大病。看起来好像废话,然而这句话是一个研究长寿健康的核心理念。
如果你规避了疾病,你就会长寿;如果你获了疾病,你就可能会受到影响。当然,进一步,你需要询问一下,到底是什么原因导致了有些人规避了疾病,运气?还是实力?这就是需要验证的了。
这句话基本上在各种研究中都得到了验证。大部分长寿的人,事实上,从来不会得那种极其严重的疾病,比如癌症,严重心血管疾病等;或者,他们会延缓这种病的发生。比如正常人大概在60岁以后某些老年性疾病就会急剧上升,比如心血管疾病,老年痴呆症或者二型糖尿病等,然而,那些极端长寿的人们,他们总体的发病率会延迟到70,80甚至90才开始。这个在生物学里有个专门的名词,叫做compression of morbidity,上个世纪有大量的群体数据支持这个结论。
所以,做长寿的,大部分人都会研究各种老年性疾病,从长寿老人为什么不得或者少得这种老年性疾病的角度去研究长寿。算是曲线救国吧。其实我还做心血管疾病,老年痴呆症。
来源: 李雷


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 李雷
李雷 
