又到了季节交换的时候,集美们,你们的皮肤还好吗?不少朋友也说了,护肤品/防晒都没少用,为什么皮肤屏障还是会受损呢?

关于肌肤屏障受损,一般轻微的受损,我们肌体的修复能力会使其尽快恢复正常。但是如果是长期的肌肤屏障受损,那么修复就十分困难了。相信这也是很多人的困扰之处,就是肌肤屏障一旦受损,用尽很多办法都不能奏效,这究竟是怎么回事呢?今天来和大家聊聊。
01,长期肌肤屏障受损为啥自身难修复?
很多人都比较好奇,按理说我们人体的细胞有强大的修复能力,可以让受损的细胞得到恢复,即便不能修复,那么也有专门的细胞凋亡系统让细胞凋亡,然后让新生细胞替代上去,形成新老更替的新陈代谢。为什么长期肌肤屏障受损,却难以通过这种自身的修复系统得到恢复呢?

其实,出现这种情况,既有可能是发生了肌肤细胞的衰老,而细胞衰老和常规的新陈代谢不一样,衰老的细胞呈现出衰老但不凋亡的情况,不仅如此,它们还会维持肌肤这种状态,导致正常的新陈代谢受阻,即使是使用了修复的营养和药物,短期似乎缓解了,但是一停药,衰老就会继续发挥作用,让肌肤屏障变成受损状态。
这就让很多人费解了,为什么我们的基因没有改变,机体也在正常代谢,为何却始终无法修复肌肤受损屏障,衰老到底有什么魔力能够持续让肌肤屏障受损呢?其实这和衰老的表观遗传有很大关系。
02,什么是表观遗传
谈到遗传,相信很多人都明白,这是和基因有关,从亲本遗传到下一代,基本上每个人生下来,其基因就基本固定了,所受到的遗传也就确立了,这是经典的遗传学。然而,近些年,科学家发现了另外一种遗传,那就是表观遗传,这种遗传和经典遗传学不同,它们是受到了后天因素的影响,并且,能够把这种遗传传递下去,这就有点像很多人曾经了解的“用进废退”的拉马克主义了。
最早观察到这种现象是在小鼠身上,当小鼠受到持续性刺激后,会形成对刺激的惊吓反应,然后研究人员发现,这种表现,并不会随着时间消退,更为严重的是,这样的小鼠,竟然能将这种记忆传递到下一代,哪怕下一代从未接触过相关的刺激,但是依然保持着对刺激的强烈惊吓反应。要知道简单的刺激并不能改变基因的序列,所以这种遗传方式就和我们经典的遗传不一样,因此科学家将其命名为表观遗传[1]。
03,表观遗传同样存在在人群中
而随后,越来越多的研究揭示,表观遗传并不只是存在于小鼠身上,而且存在与其他物种,包括人类身上。比如二战的时候,荷兰曾经遭遇过包围导致1944年爆发的荷兰大饥荒,在面对饥饿的时候,人体和能量代谢相关的胰岛素样生长因子 IGF2 的合成减少。这种情况,在二战结束后,哪怕是人们生活水平得到了恢复甚至极大的改善,但是这种低表达的IGF2的情况在那个大饥荒过程出生的群体中一直得到了维持,甚至在60年后的今天,这种情况依然存在,这就是表观遗传在人群中的证据之一[2]。

而衰老过程中,一样发生了表观遗传,在衰老过程中发生了大量的表观遗传变化 [3]
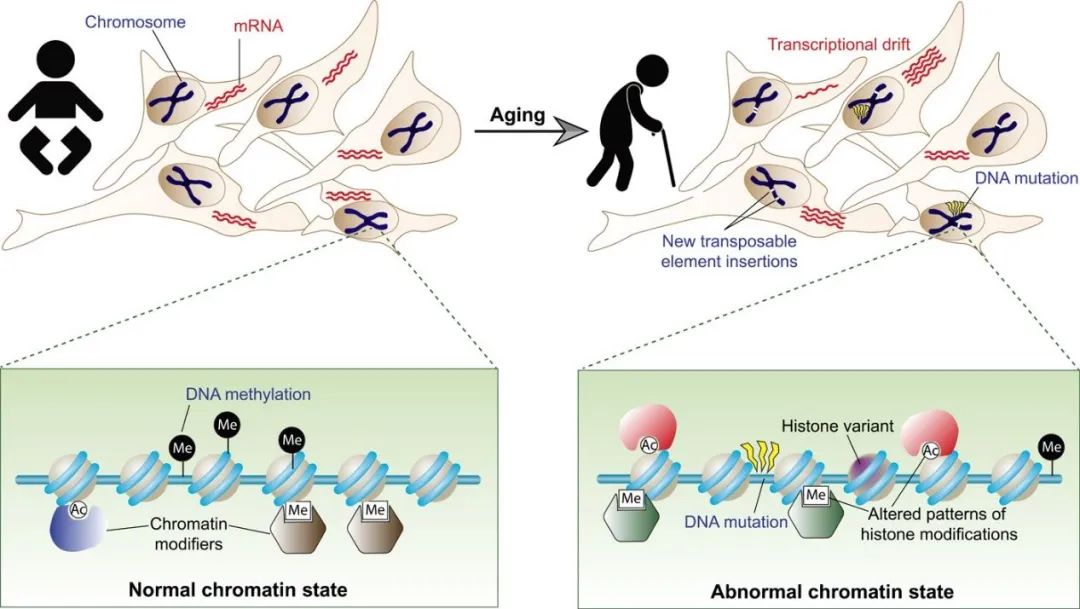
这个过程中会呈现出总体组蛋白的丢失、组蛋白激活和抑制的平衡被打破,进一步引发了基因转录的失调。这种调控持续下去,那就是表现出衰老细胞中的基因表达总体发生了改变,并且由于表观遗传一旦发生,往往会源源不断的维持,于是就出现了衰老细胞十分难以修复,肌肤屏障难以得到很好地解决。这也是护肤中的最大难题。
04,如何应对这种现象?
那么是否真的无能为力了?当然不是。表观遗传其实最终也是落到了基因表达上,通过影响基因表达来发挥作用,那么我们寻找到可以调节基因表达的因子,那么就可以改善老化了。
而微小RNA(micro RNA)正好是这样一种分子。我们的基因尾部会存在一段区域,我们称之为3‘UTR(Untranslated Regions),这段区域并不翻译,但是却是micro RNA结合的区域,而microRNA通过和该区域的结合及解离,可以很好的调控基因的表达。
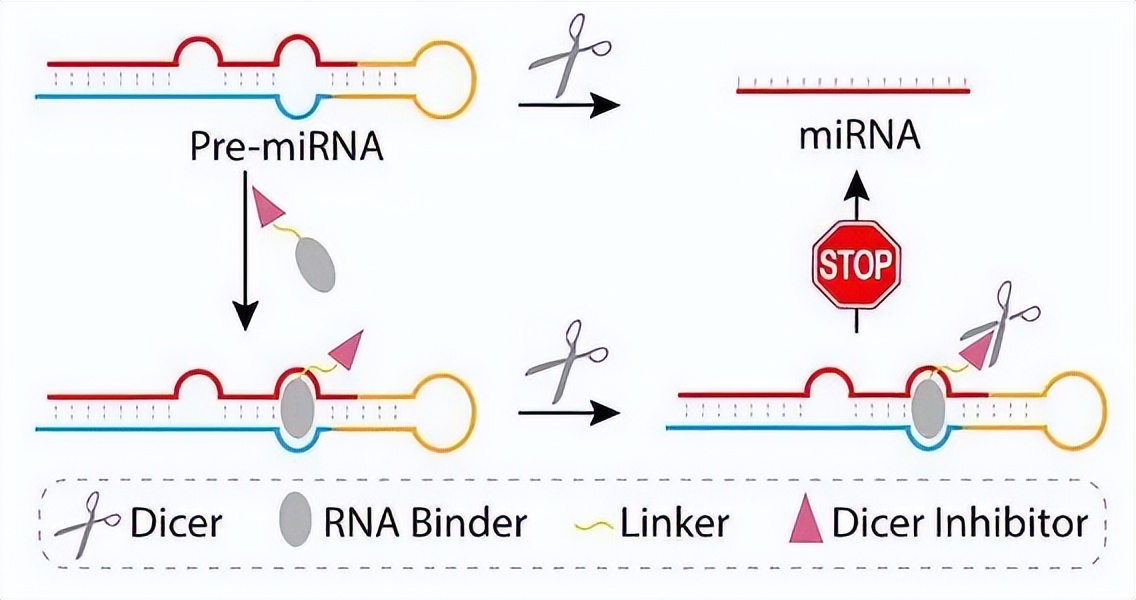
由于miRNA这种物质可以体外合成,极大的方便了生物医学领域的研究,使得我们不再需要大量的基因操作来进行干预基因,推动了整个生物医学对基因表达调控研究,因此获得了2006年的诺贝尔奖。如今miRNA更是已经推广到临床应用中,对于许多传统医药难以解决的疾病发挥了巨大作用[5]。
这一策略,同样可以应用于肌肤屏障受损的修复中。和传统的药物不一样,肌肤屏障受损是细胞衰老的过程,由于发生了表观遗传而使得基因表达被持续的改变了。这种情况下,使用miRNA来解除表观遗传,就是对症下药了。
可以说,这是衰老表观遗传领域近些年来值得称道的一种实际应用,目前衰老领域的研究还在进行中,比如二甲双胍的实验,相信随着大量的研究的推进,未来我们不仅可以解决肌肤细胞衰老问题,甚至是全身性的个体衰老都可能逆转。
1、Dias, Brian G., and Kerry J. Ressler. "Parental olfactory experience influences behavior and neural structure in subsequent generations." Nature neuroscience 17.1 (2014): 89-96.
2、Heijmans B T, Tobi E W, Stein A D, et al. Persistent epigenetic differences associated with prenatal exposure to famine in humans[J]. Proceedings of the National Academy of Sciences, 2008, 105(44):
3、Rando, Thomas A., and Howard Y. Chang. "Aging, rejuvenation, and epigenetic reprogramming: resetting the aging clock." Cell 148.1-2 (2012): 46-57.
4、Bird A. DNA methylation patterns and epigenetic memory[J]. Genes & development, 2002, 16(1): 6-21.
5、Zimmermann, Tracy S., et al. "RNAi-mediated gene silencing in non-human primates." Nature 441.7089 (2006): 111-114.
来源: 李雷


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 李雷
李雷 
