作者:莫轩
编辑:Yuki
这两天,“基因编辑婴儿”在中国诞生的爆炸性新闻,在全球范围内掀起了巨大争议。这个事件也让以CRISPR为代表的基因编辑技术,又一次被推上风口浪尖。
其实,就在不久前,CRISPR技术的专利归属问题才刚刚尘埃落定——美国联邦法院判定麻省理工学院和哈佛大学获得CRISPR专利,结束了关于这场长达5年的争论。
作为目前最有效的基因编辑技术,CRISPR技术到底经历了哪些发展与争议,它所代表的基因编辑技术又将走向何方呢?

(图片来源:图虫创意)
CRISPR的诞生
事情要从1987年说起。这一年,日本科学家第一次在大肠杆菌的基因组中发现了重复性回文序列,然而,当时并未引起诸位学者的注意。
两年以后,西班牙阿利坎特大学的博士研究生Francisco Mojica在做自己的博士课题时,在一种名为 H.volcanii 的古细菌中也发现了重复性回文序列。他查了文献,发现两年前的日本科学家也发现了类似的回文结构,通过比较发现,两者并未有任何同源序列。
虽然不知道这些回文结构有什么功能,但他觉得非常有意思,并将其命名为Clustered regularly interspaced short palindromic repeats [1] ,简称CRISPR,翻译过来大致是“ 簇状规律型间隔回文序列 ”。1992年,他发表了一篇文章,描述了这个回文结构,并顺拿到博士学位,到牛津大学做了两年的博士后。博士后出站以后,他回聘到阿利坎特大学,重拾了他博士时期发现的CRISPR的研究工作。
钻研了十余年,到2003年,他终于弄明白这个回文结构的生物学功能—— 古细菌的适应性免疫 [3]。 为此,他和他的课题团队成员开了一个盛大的party庆祝,并且觉得这个工作一定能发表在《科学》、《自然》等世界顶级期刊上。派对结束后的第二天,Mojica就开始撰写论文,投稿到这些顶级杂志。
这些期刊的编辑们虽然对这一工作表示了足够的兴趣,但是指出Mojica的工作并没有阐释机理,而只是在做假设,就拒稿了。在长达两年的反复拒稿以后,文章最终发表在了《分子进化》(Molecular Evolution)上。
与此同时,法国学者Bolotin在研究酿脓链球菌 Streptococcus thermophilus 时发现了与Mojica研究组相似的CRISPR序列,以及一个新的基因,用来编码一个具有核酸酶功能的蛋白,也就是后来的Cas9,并预测CRISPR的功能大约是与适应性免疫相关 [4] 。
这篇文章提交的时间大约比Mojica文章被接受的时间早两个月。
在接下来的四五年间,世界各地的科学家们似乎忽然有了指路明灯一般,很快搞清楚了CRISPR序列的功能,以及细菌适应性免疫的工作机制—— Cas蛋白具有核酸酶的功能,能够剪切DNA,而CRISPR能够转录成RNA引导Cas蛋白对基因组中特定的DNA序列进行剪切 。
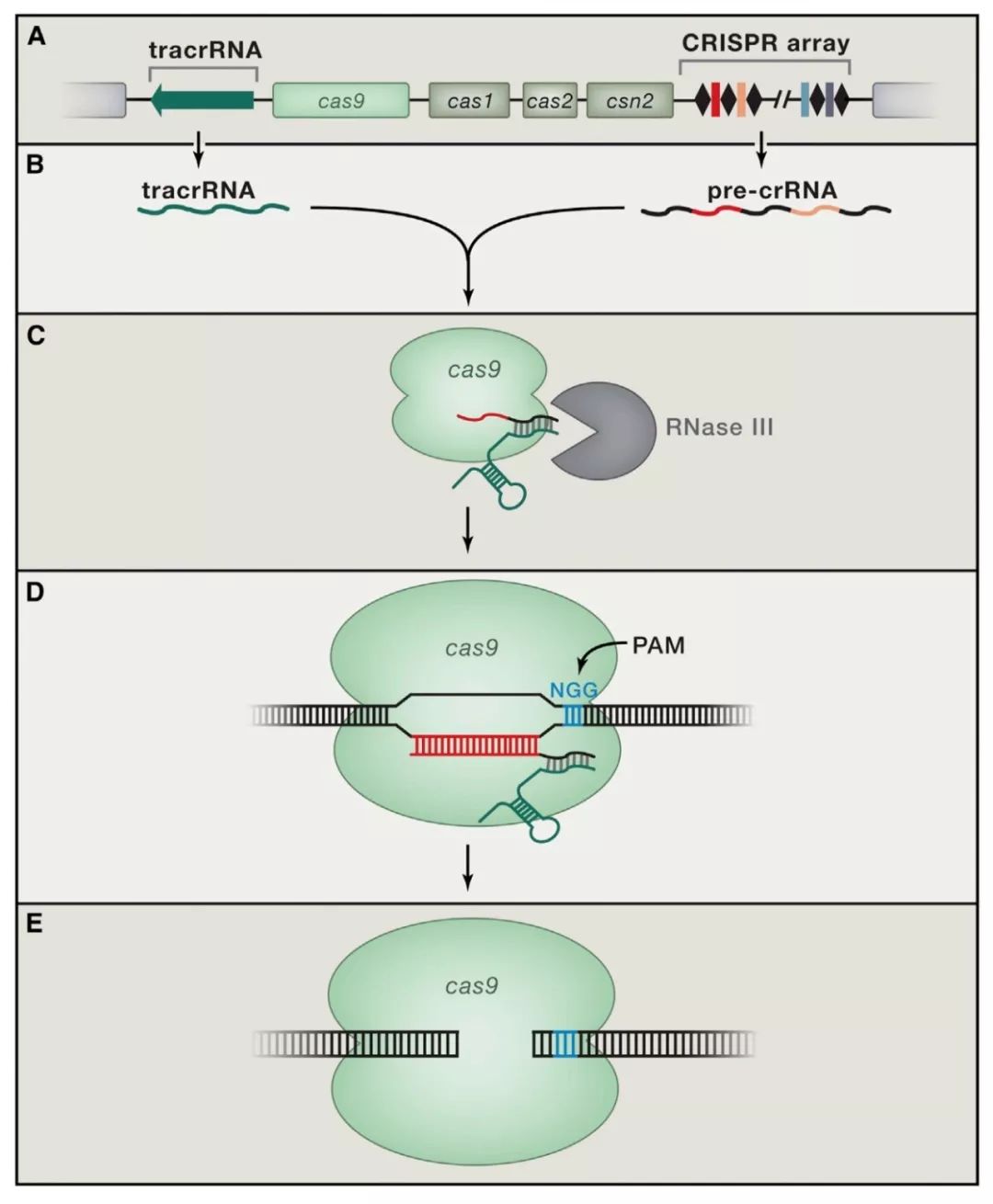
(酿脓链球菌( Streptococcus thermophilus )中的CRISPR-Cas9系统。图源:参考文献[2])
到了2012年,Jennifer Doudna发文将CRISPR系统用于大肠杆菌基因组的编辑。2013年,Feng Zhang(张锋)发文报道了CRISPR技术用于动物细胞基因组的编辑工作。
正是这两个研究组,在接下来几年,为了谁最先发明CRISPR技术,展开了激烈的争论。虽然,从论文发表时间上说,确实是Doudna领先一步,但是,张锋2014年就已经申请到了CRISPR技术的发明专利。

(张锋申请的CRISPR技术专利。图源:patents.justia.com)
科学之争or利益之争?
虽然外行人会抱有“看热闹,不嫌事儿大”的心态,但是对科学家们来说,谁做了什么工作,做了多少工作,都心里有数。
那么争议来自哪里呢?是科学家自身吗?
我们先来看一些事件——
就在专利之争尘埃落定的前一年,UCB的学生社团邀请张锋去UCB做一个关于CRISPR技术的报告。而在此之前,一位UCB的学生就已经在推特和脸书上发文,号召大家通过点赞的方式支持Jennifer Doudna,反对张锋。
一周后,学院的一位资深教授特地找她谈话:你不要这样搞事情,张锋并不是坏人,他也没有做任何坏事。
不止是这位教授,在许多科学家们眼中,张锋是一位非常腼腆的人,他并不想参与纠纷,只是想把科研做好。这次他之所以接受UCB的邀请,也是因为他看来这只是一个正常的科学交流。对“CRISPR技术专利之争”这一问题并没有发表过多评论,只是介绍了一些他最初的工作。
其实,早在2014年,张锋获得CRISPR技术专利许可以后,就将这项技术以及实验室所有的相关实验材料信息公之于众,免费供全世界学者和机构科研之用。
2017年底,张锋当选为美国科学院院士,也可以反映出科学界对张锋的贡献是非常认可的。
所以,从这些层面上来说, CRISPR技术专利之争,并不是科学之争 。争论的主角也并非这三个研究机构,而是与这三个机构所有关的诸多大型生化公司。
因为技术的应用,离不开产业化,MIT和UCB为代表的研究机构只负责科学研究,成果转化必须依靠对应的大公司。所以, 所谓的专利之争,其实是各个公司的产品和市场之争。
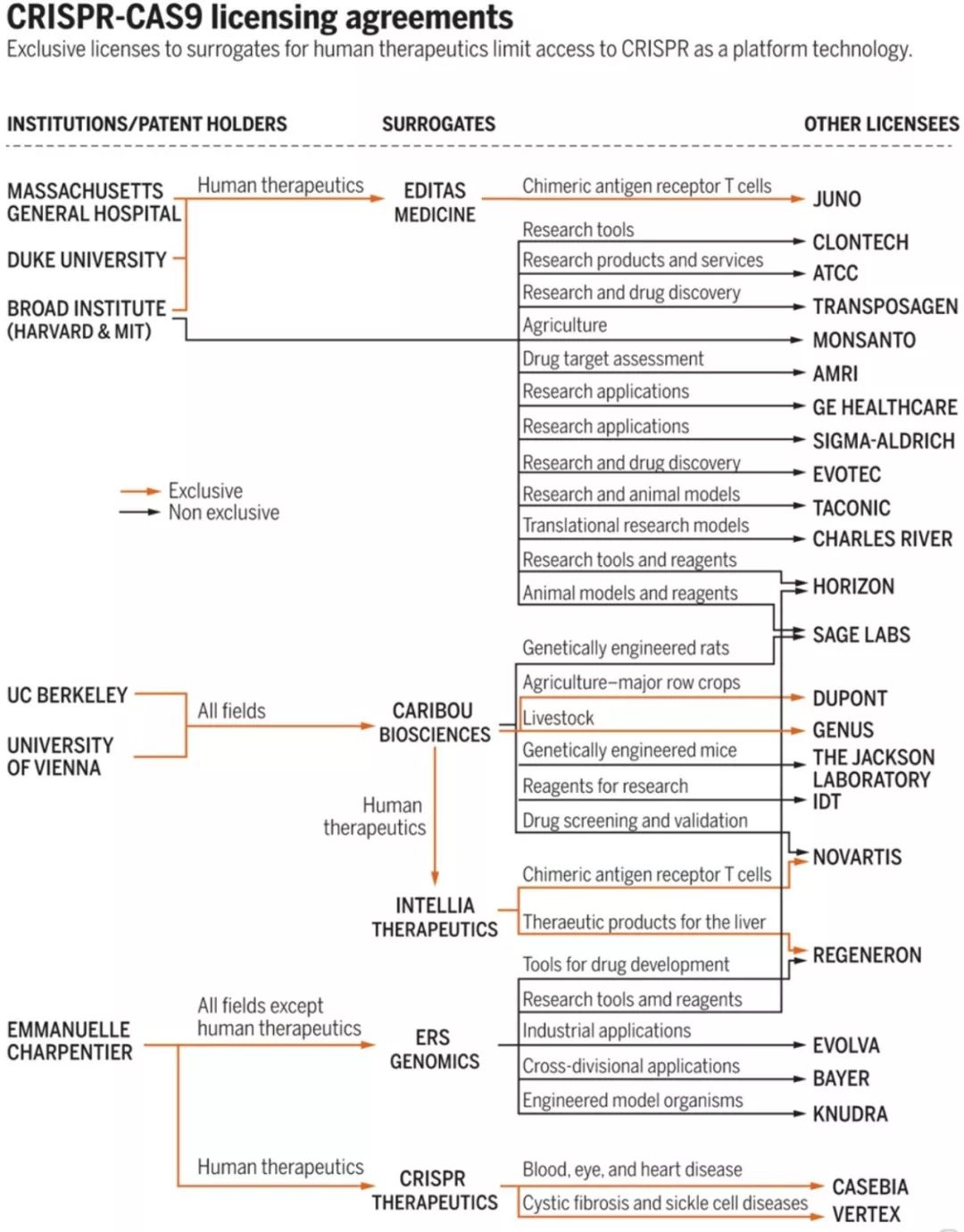
(以MIT,UCB为代表的三家机构,以及专利许可授权以后,各大公司成果转化专利。图源:Nature)
CRISPR技术——一把“未打磨好的利刃”?
美国联邦法院的判决,算是暂时平息了这场纷争。可是人们不禁要问了,CRISPR技术到底有哪些用处?为何导致三家机构不惜耗巨资打官司呢?
原因说起来也很简单——这项技术是目前为止 最为有效的基因编辑技术 。已经普遍应用到医疗、农业等诸多方面。
虽说它是目前最行之有效的技术,但并不能代表着百分之百的可靠。
作为一把基因编辑的利刃,CRISPR目前存在一个重要的缺陷—— 脱靶 。简单的说就是,这把刀虽然很锋利,但是,经常砍错地方。
一项关于人类胚胎细胞的修饰研究工作中,CRISPR技术的成功率仅为14.3%——这么低的精度在医学上是不可能被接受的。从这点上说,现行的CRISPR技术仅仅是一把未打磨好的利刃。
CRISPR技术将走向何方
基因编辑技术无疑将成为未来一项非常重要的技术。目前为止, CRISPR技术主要应用在农业和医学方面,并取得一些成果 。比如农业方面,这项技术主要用来改造植物基因组,用以制造耐旱或者抗病的株系。如今已经成功应用到大豆,玉米,烟草,番茄,小麦等农作物上,很多成果转化也会在未来逐一呈现 [5] 。
临床上,这项技术被用于一些遗传疾病的筛选、预防和治疗。一些治疗方案在动物疾病模型中已经取得很好的效果。此外,还能改造人体免疫细胞——T细胞,让它们能够特异的靶向癌细胞,达到癌症治疗的目的。
CRISPR的研究还不止于此,一项最新的研究利用CRISPR技术创造出可编程的核酸成像技术,能够跳过了转录、翻译两个步骤,直接观察到蛋白的表达。另外一项研究中,研究人员将绿色荧光蛋白融合在dCas核酸酶上,并在末尾加了一段特殊优化的RNA序列,实时观察到端粒上的动态结构以及细胞内的基因编码过程 [6,7] 。

(CRISPR-Cas核酸成像技术:正进行有丝分裂的海拉细胞中的一个基因的亚细胞定位。)
此外,目前研究最多的是Cas9。而Cas蛋白家族还有一大家子成员,如Cas12a, Cas13, Cas10等 [8,9] 。很多成员的功能很奇特,比如Cas13具有RNA酶的功能可以对RNA进行识别和编辑。现在人们已经可以利用Cas13发展RNA成像技术以及快速检测萨卡病毒的单链RNA。这无疑对于疾病的预防极为重要。

(Cas蛋白家族。图源:参考文献[1])
总之,虽然CRISPR-Cas技术目前仍存在许多问题,但并不能掩盖其巨大的应用价值。这项技术已经为人类的社会科技的发展打开了一扇窗,“宝剑锋自磨砺出”,我们期待CRISPR这把利刃,能在众多科研人员的努力下,被不断打磨和完善,使之为人类创造更多的价值。
不过至少在现阶段,它还不能成为解锁人类基因技能的“万能钥匙”,一切操作仍需谨慎——虽然技术本无正邪之分,但使用技术的人,将决定它最终的走向。

作者名片

参考文献:
1. Knott, G. J. & Doudna, J. A. CRISPR-Cas guides the future of genetic engineering. Science 361, 866 (2018).
2. Lander, Eric S. The Heroes of CRISPR. Cell 164, 18-28, doi:https://doi.org/10.1016/j.cell.2015.12.041 (2016).
3 . Shan, Q. et al. Targeted genome modification of crop plants using a CRISPR-Cas system. Nature Biotechnology 31, 686, doi:10.1038/nbt.2650
https://www.nature.com/articles/nbt.2650#supplementary-information (2013).
4 .Chen, B. et al. Dynamic Imaging of Genomic Loci in Living Human Cells by an Optimized CRISPR/Cas System. Cell 155, 1479-1491, doi:10.1016/j.cell.2013.12.001 (2013).
5.Knight, S. C., Tjian, R. & Doudna, J. A. Genomes in Focus: Development and Applications of CRISPR-Cas9 Imaging Technologies. Angewandte Chemie International Edition 57, 4329-4337, doi:doi:10.1002/anie.201709201 (2018).
6.Gootenberg, J. S. et al. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6. Science 360, 439 (2018).
9.Myhrvold, C. et al. Field-deployable viral diagnostics using CRISPR-Cas13. Science 360, 444 (2018).



 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助