作者:鬼谷藏龙
编辑:Yuki
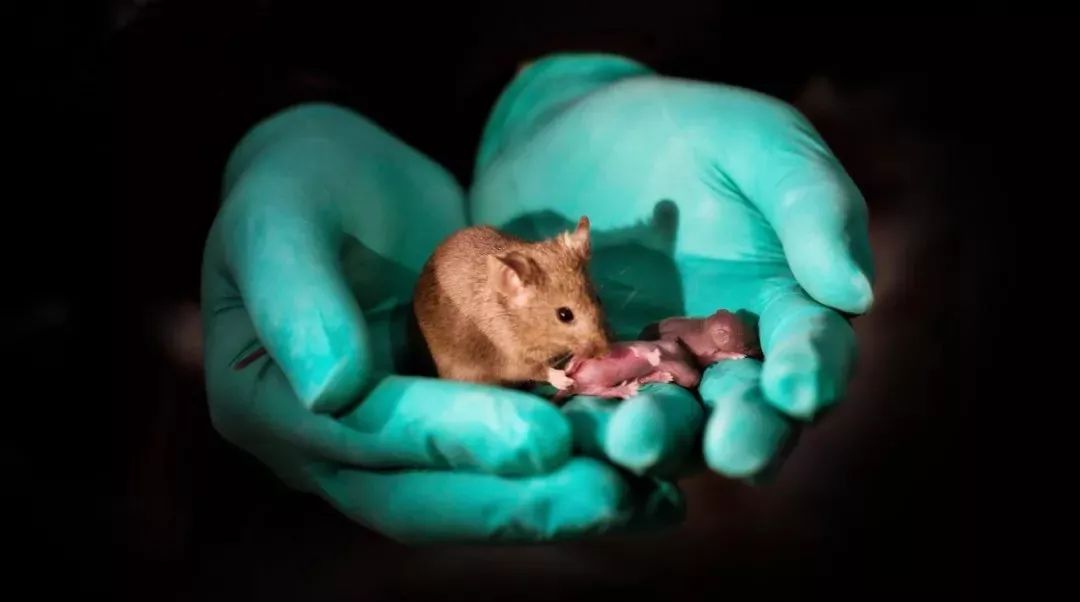
就在前不久,两只刚出生的小鼠突然成名网络——不是因为它们太可爱了,而是因为它们是 世界上首例由两只雄性产生的哺乳动物幼崽 。

不了解的人大概会问:这有啥稀奇的?同性繁殖在动物界不也很常见嘛!小强(蟑螂)不是没有雄性也能繁殖?一些两栖动物和鱼类还能自由切换爹妈角色呢……
确实,很多动物都有同性繁殖的现象,但对于哺乳动物而言,这还真不是个简单事儿—— 迄今为止,没有任何哺乳动物能在自然情况下实现同性间繁殖后代 。
而早在上世纪七八十年代,就有科学家偏偏不信这个邪,他们一定要看看把两个哺乳动物精子或两个卵子合在一起会发生点啥——结果这些同性胚胎头几天好像还在正常发育,但是发育到一定程度,就会出现一道迷之结界,使它们纷纷“胎死腹中”。
这样的现象让科学家们大为不解,也深感兴奋!为啥哺乳动物就这么特殊?嗯,我们一定要搞清楚……

(嗯,我们一定能搞清楚……)
印记基因: 阻止同性生育的分子壁障
一位来自南斯拉夫的科学家达沃尔·索特(Davor Solter),在 1988年首次找到了这个问题的答案,也因此荣获了今年的盖尔德纳国际奖 。他发现,是一种叫做“印记基因”的存在,为哺乳动物同性生育架设了高高的壁垒。

(达沃尔·索特(Davor Solter),印记基因的发现者。图:ie-freiburg.mpg.de/solter-gairdner2018)
那么,哺乳动物为什么要有这样的“壁垒”呢?还不是因为娃难带嘛……
其他动物生了娃(蛋)大多不是拍拍屁股走了就是雌雄一起抚养孩子,但哺乳动物的幼崽就麻烦多了——胚胎时期怀在肚子里要吸收营养,出生了还要继续靠吃奶来吸收营养,关键是,这些营养全部由雌性一方承包,雄性在这个过程中却大多仅需要贡献一点精子。 这种巨大的育儿投入上的差异促使哺乳动物的两性采取了截然不同的繁殖策略 。
对于雌性来说,生养大胖小子无疑会大量损耗自身精力,所以它们采取了“留得青山在,不怕生二胎”的策略——对卵子当中的基因动一系列的手脚, 增强那些能够阻滞胚胎发育的基因 ,同时抑制那些能够促进胚胎发育的基因,尽力让孩子发育得相对瘦弱一些。

然而对于雄性来说,孩子长得壮壮的以后才能挨得起饿扛得了揍,对于是否好生养似乎不是特别关心。所以雄性也会对精子当中的基因做一系列相反的手脚, 拼命去促进胚胎发育 。

于是,一边是雌性希望幼崽变弱变小变萌,另一边是雄性希望幼崽变大变壮变强……经过一亿多年这样的两性斗争,哺乳动物卵子和精子中的基因都被矫枉过正到了非常极端的地步,这反而让精子和卵子的两套染色体谁也离不开谁了——因为一旦这个平衡被打破,无论偏向雌雄哪方都会导致胚胎发育严重失调,这就是那道同性发育结界的本质(诚可谓是相爱相杀)。

(父母对生娃的想法都不统一,娃还能说什么……)
这些在哺乳动物雌雄双方博弈中被动过手脚的基因,就像是双方分别在自己配子基因组中打上的“性别印记”,因此被称为“ 印记基因 ” [1] 。
孤雌生殖: 逆天改命辉夜姬
不过,索特老爷子仅仅是发现了“印记基因”,并没有彻底弄清楚这些“印记”是怎么打上去的,也不知道如何能解开哺乳动物同性繁殖的“封印”。
于是,接下来的问题又吸引了一大群科学家前仆后继一一其中特别值得一提的是东京农业大学的友广川野(Tomohiro Kono)教授。

(友广川野(Tomohiro Kono),第一只孤雌小鼠的创造者。图片来源:东京农业大学官网)
友广川野早年曾长期研究克隆技术,并逐渐对胚胎发育过程中印记基因的变化产生了兴趣。友广发现,两性给基因打上“印记”其实是一个跨越整个性成熟过程的漫长工作。
那么反推过来,动物刚刚出生的时候,就必定有大量的印记基因还没来得及打上“性别印记”,而这时候动物体内尚未发育成熟的卵子其实正处在一个非常接近“ 性别中性 ”的状态 [2] 。
由此,友广有了一个大胆的想法—— 如果利用这种“性别中性”的卵子,是不是就能实现哺乳动物的“孤雌生殖”了呢 ?

这个主意好!
不过事实证明,哺乳动物的发育还是比较复杂,不是说“性别中性”了就能随意结合。经过大量的摸索,友广设计出了一套“雄性化”小鼠卵子的方法。
如何“雄性化”呢?
首先,友广培育出了一种经过基因改造的母鼠,它们被人为删除了一个最强力的雌性印记基因和一些基因元件,使之转而表达一个强力的雄性印记基因。
他从这种“雄性化”鼠的幼鼠卵巢里取出不成熟的、还没打上太多“性别印记”的卵子A,然后用一个去掉核的正常小鼠卵子B将其“催熟”,于是,一枚表达类似雄性印记基因的卵子就诞生了。
2004年,他将这些“雄性化”卵子AB和普通的卵子C相融合,终于得到了人类历史上第一只“孤雌生殖”产生的小鼠 [3] 。
这只创造历史的小鼠被命名为“辉夜姬”。辉夜姬是日本小说《竹取物语》中一位诞生在竹子里的公主,恰如友广的小鼠一样,没有生物学意义上的父亲。

(日本小说《竹取物语》中一位诞生在竹子里的公主辉夜姬。图片来源:douban)

(史上第一只孤雌小鼠“辉夜姬”以及它生的孩子。图片来源:参考资料3)
之后,友广又不断改进他的方案,最终在2007年用一套删除两个印记基因的方案将“孤雌小鼠”的存活率提高到了15%左右 [4] 。

(孤雌小鼠从此不是稀罕货。图片来源:参考文献[4])
这些“孤雌小鼠”虽然在理论上大大拓展了人类对于印记基因的理解,但是“雄性化”卵子需要异常繁琐的实验操作——既要制作基因改造的母鼠,又要从初生幼鼠那比针眼还小的卵巢里取卵,想想都不是个轻松活儿。
那么, 有没有什么更容易的办法来获得没有“印迹”的配子呢 ?
单倍体胚胎干细胞: 柳暗花明又一村
说起来,这个难题的解决竟然和一种肿瘤相关。
这种肿瘤叫做卵巢畸胎瘤,它是由个别自以为受精的卵子发育成的胚胎异变而成。虽然这种胚胎长得不正常,但是里面也含有胚胎干细胞,它们被称为“ 孤雌胚胎干细胞 ”。
2011年,奥地利科学家约瑟夫·彭宁格(Josef M. Penninger) [5] 与英国科学家安东·武兹(Anton Wutz) [6] 几乎同时独立发现,有一些孤雌胚胎干细胞当中的遗传物质和卵子一样保持着单倍体的状态,而且利用一些特殊的培养方法,这种单倍体的状态是可以长期保持的。这样的细胞就是后来对哺乳动物同性繁殖意义重大的“孤雌单倍体胚胎干细胞”。

(约瑟夫·彭宁格(Josef M. Penninger,左)与安东·武兹(Anton Wutz,右)两人几乎同时发现了小鼠孤雌单倍体胚胎干细胞。图片来源:wikimedia commonsÐ官网)

(建立孤雌胚胎干细胞系的一种流程。图片来源:Wei Li et al. (2014) Cell Stem Cell 编译:鬼谷藏龙)
在之后的研究中,人们发现,这些孤雌单倍体胚胎干细胞的“印记状态”和卵子几乎一模一样。但是这些“印迹”会随着体外培养而逐渐丢失,最终退化到一种类似于幼鼠卵子那样“性别微弱”的状态。
2015年,上海生化细胞所的李劲松研究员的团队,将友广方案中的雄性化幼鼠卵子换成了小鼠孤雌单倍体胚胎干细胞,果然也一样可以生出“辉夜姬”那样的孤雌小鼠 [9] 。
(只有母亲,没有父亲的小鼠发育一切正常,自己也成功产下了后代(图片来源:Leyun Wang,中国科学院动物研究所))
眼看着小鼠的孤雌生殖技术平步青云,人们不由发问, 既然孤“雌”有了,“孤雄”哺乳动物啥时候出生呢 ?
双雄争孤雄
当然了,之前并不是没人想过去实现哺乳动物的“孤雄繁殖”,只是“孤雄”比“孤雌”更难做到。雌性天生有卵子,所以能在出生后就获取,而雄性只有性成熟后才会产生精子(此时均为打上“印记”的精子了),所以不能复制友广在雌鼠上的操作方案。
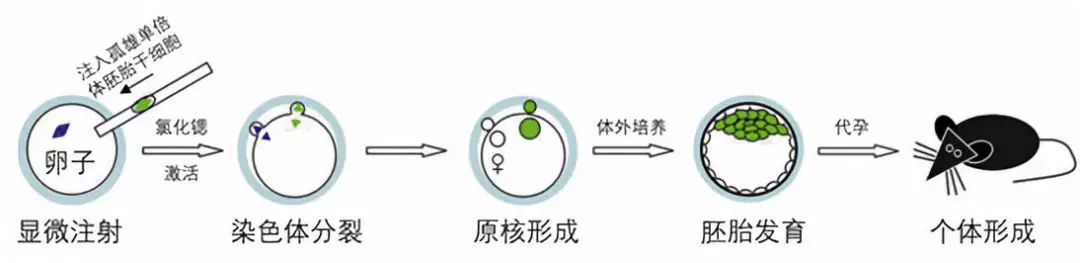
而这个“巧妇难为无米之炊”的难题,在单倍体胚胎干细胞被发现之后才有了新的进展——当彭宁格与武兹的成果刚一公布,李劲松的研究团队就马上想到,既然有办法让卵子直接发育产生成孤雌单倍体胚胎干细胞,那么如果我 把卵细胞核去掉后往里面放一枚精子,不就能拿到孤雄单倍体胚胎干细胞了么 ?

(通过向去核卵细胞注入精子来建立孤雄胚胎干细胞系。图片来源:参考资料7,鬼谷藏龙编译)
不过与此同时,另一个实验室也想到了这一点,那就是中国北京动物所的周琪实验室。
李劲松和周琪的课题组,研究方向大同小异,在业界也可谓一时瑜亮,遇到这个炙手可热的项目后,两组人马几乎是在同一时间用完全相同的思路开启了完全相同的课题。
在这一轮较量中先拔头筹的是李劲松实验室,他们仅仅用了半年就率先制出了小鼠孤雄单倍体胚胎干细胞 [7] ,周琪实验室则过了几个月才迎头赶上 [8] 。

(李劲松(左)与周琪(右)都是国内最顶尖的胚胎干细胞专家之一。图片来源:生化细胞所与动物所官网)
不出所料,这些孤雄单倍体胚胎干细胞保持着精子的“印迹”,在合适的条件下,孤雄单倍体胚胎干细胞完全可以像精子那样,让卵子受精并正常发育 [7,8] 。而且,和之前的孤雌单倍体的情况一样,孤雄单倍体胚胎干细胞在培养一段时间后,其“雄性印记”也会逐渐退化,使其变成“微弱的”雄性。
(孤雄单倍体胚胎干细胞可以像精子一样给卵子受精,产生后代。图片来源:参考资料7,鬼谷藏龙编译)
周琪实验室已然连败两局,唯一扳回一城的希望就是在孤雄小鼠上面抢得先机了。
孤雄小鼠: 近在咫尺尚未及
如果说孤雌小鼠好歹还有友广川野的先例可以参考,那么孤雄小鼠就是纯粹的从头摸索了。
理论上来说,将孤雌小鼠的方案“反过来”,删掉孤雄单倍体胚胎干细胞里面的一些雄性印记基因,使之“雌性化”,然后将这样的细胞和精子一起注射到去核的卵子当中,应该就能生出孤雄小鼠来了。话虽没错,但实际操作起来往往就是另一回事了。
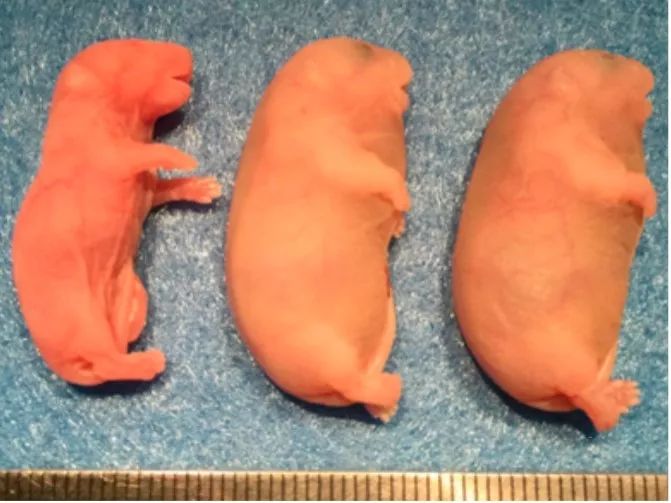
在之前的研究中,研究人员都发现,孤雌小鼠毕竟其“雄性印记”比较弱势,所以经常会出现发育迟缓、体型瘦小等问题,与此同时,这些小鼠会意外的长寿。

(发育不良(右侧两只)是孤雌小鼠经常遇到的问题。图片来源:参考文献[3])
周琪的研究团队首先想要试试看能不能解决这个问题,这样也好给未来制作孤雄小鼠积攒一些技术经验。他们在友广删除两个印记基因的方案基础上设计了一种删除三个印记基因的策略,终于得到了比较正常孤雌小鼠 [10] 。
那么,获取孤雄小鼠又需要删除几个印记基因呢?周琪团队发现,删除了六个印记基因后,移植到代孕母亲子宫内的胚胎中也只有1.2%的孤雄小鼠能够发育到足月,且生出来的只是一个外形极不正常的畸形死胎。
与孤雌小鼠恰好相反,孤雄小鼠幼崽表现出了一系列发育过度的问题 ——有的小鼠肿胀成了一个肉球,有的内脏跑到了体外,还有一些则在胚胎时期就睁开了眼睛(因为眼球过大把眼皮给“撑”开了)。
(孤雄小鼠遭遇的首要问题就是发育过度,图中右边两只就是长成了“肉球”的孤雄小鼠。图片来源:参考文献[10])
最后,周琪的团队删除了七个印记基因,才终于让孤雄单倍体胚胎干细胞变得足够“雌性化”,产生形态上比较正常的小鼠。它们所制作并植入代孕母鼠子宫的477个孤雄胚胎中,有12个活到了出生,不过其中大多数都有严重的浮肿,出生后不久便撒手鼠寰。只有两只表面上看不出什么问题的孤雄小鼠坚持活了48小时以上。而这,就是目前所能做到的极限了。
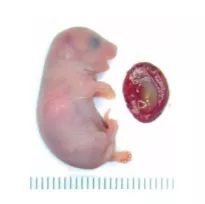
(删除7个印记基因后,周琪团队终于得到了外貌比较正常的孤雄小鼠(右侧是它的胎盘)。图片来源:参考文献[10])
孤雄小鼠被创造出来了吗?严格来说,并没有。 周琪的工作,最多只是在理论上证明了孤雄小鼠的可能性。按照正常的操作,只有当孤雄小鼠能够长到成年并产生自己后代,才能算真正意义上实现“孤雄繁殖”。但无疑,周琪的团队目前获得的成果,肯定也已经尝试过很多印记基因的修改方案,倾其所能了。

(造出只有父亲,没有母亲的小鼠,可以说是一个突破。图片来源:Leyun Wang,中国科学院动物研究所)
说来也巧,笔者在四年前的这时候,写的第一篇科普文章恰好就是讲小鼠孤雄单倍体胚胎干细胞(详情点击文末阅读原文查看),那个时候小鼠孤雄单倍体胚胎干细胞刚发现不久,技术上还非常青涩,几乎没什么人想到以后它可以做出“孤雄小鼠”来。
然后短短几年间,看着无数的科学家“你一针我一线”,把这个技术逐渐编织完整,也不由感叹——他们当中没有谁是带着要一鸣惊人改变世界的念头去做研究,许多奇迹就这样从不经意的萌芽中“长”了出来,而且未来还会继续开花结果。
说到这里,人类迄今为止在探索哺乳动物同性生育的故事就基本讲完了,然而作为人类科学史册的一部分,这个故事注定还会有新的篇章。
作者名片

排版:小爽
题图来源: Leyun Wang,中国科学院动物研究所
参考文献:
1.Solter, D. (1988). Differential imprinting and expression of maternal and paternal genomes. Annual review of genetics, 22(1), 127-146.
2.Obata, Y., Kaneko-Ishino, T., Koide, T., Takai, Y., Ueda, T., Domeki, I., ... & Kono, T. (1998). Disruption of primary imprinting during oocyte growth leads to the modified expression of imprinted genes during embryogenesis. Development, 125(8), 1553-1560.
3.Kono, T., Obata, Y., Wu, Q., Niwa, K., Ono, Y., Yamamoto, Y., ... & Ogawa, H. (2004). Birth of parthenogenetic mice that can develop to adulthood. Nature, 428(6985), 860.
4.Kawahara, M., Wu, Q., Takahashi, N., Morita, S., Yamada, K., Ito, M., ... & Kono, T. (2007). High-frequency generation of viable mice from engineered bi-maternal embryos. Nature biotechnology, 25(9), 1045.
5.Elling, U., Taubenschmid, J., Wirnsberger, G., O'Malley, R., Demers, S. P., Vanhaelen, Q., ... & von Melchner, H. (2011). Forward and reverse genetics through derivation of haploid mouse embryonic stem cells. Cell stem cell, 9(6), 563-574.
6.Leeb, M., & Wutz, A. (2011). Derivation of haploid embryonic stem cells from mouse embryos. Nature, 479(7371), 131.
7.Yang, H., Shi, L., Wang, B. A., Liang, D., Zhong, C., Liu, W., ... & Li, D. (2012). Generation of genetically modified mice by oocyte injection of androgenetic haploid embryonic stem cells. Cell, 149(3), 605-617.
8.Li, W., Shuai, L., Wan, H., Dong, M., Wang, M., Sang, L., ... & Wang, L. (2012). Androgenetic haploid embryonic stem cells produce live transgenic mice. Nature, 490(7420), 407.
9.Zhong, C., Xie, Z., Yin, Q., Dong, R., Yang, S., Wu, Y., ... & Li, J. (2016). Parthenogenetic haploid embryonic stem cells efficiently support mouse generation by oocyte injection. Cell research, 26(1), 131.
10.Li, Z. K., Wang, L. Y., Wang, L. B., Feng, G. H., Yuan, X. W., Liu, C., ... & Li, Y. F. (2018). Generation of Bimaternal and Bipaternal Mice from Hypomethylated Haploid ESCs with Imprinting Region Deletions. Cell Stem Cell.



 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助