我们都知道,生物体利用酶加速体内的化学反应,如果缺少酶,生物体内的许多化学反应就会进行缓慢。酶属于生物催化剂,是由植物、动物和微生物产生的具有催化能力的有机物。酶在生理学、医学、农业等领域都有重大的意义。
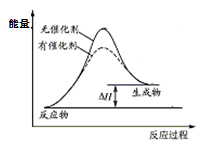
那么,化学领域是如何定义催化剂的?在化学反应里能改变反应物化学反应速率(提高或降低)而不改变化学平衡,且本身的质量和化学性质在化学反应前后都没有发生改变的物质叫催化剂。催化剂对化学反应速率的影响非常大,一些催化剂可以使化学反应速率加快至几百万倍以上。在一个化学反应中,催化剂的作用是降低该反应发生所需要的活化能,本质上是将一个难以发生的反应转变成两个比较容易发生的化学反应。在这两个反应中,第一个反应中催化剂参与反应作反应物,第二个反应中又生成了催化剂,所以从总的反应方程式上看,催化剂在反应前后未有任何变化。例如,双氧水分解过程中使用氯化铁溶液作为反应的催化剂,过程如下:
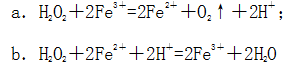
催化剂和反应体系的关系就像锁与钥匙的关系一样,具有高度的选择性(或专一性)。一种催化剂并非对所有的化学反应都具有催化作用,例如二氧化锰在双氧水分解中起催化作用,可以加快化学反应速率,但对其它的化学反应不一定会产生催化作用。某些化学反应也并非只有唯一的催化剂,例如双氧水分解中能起催化作用的有二氧化锰、氯化铁、硫酸铜等。选用不同的催化剂会影响反应产物,例如,乙醇在铜做催化剂的条件下生成乙醛和氢气,但是在氧化铝做催化剂的条件下生成乙烯和水。
酶是生物催化剂。酶的催化作用同样具有选择性。例如,淀粉酶催化淀粉水解为麦芽糖,麦芽糖在肠液中麦芽糖酶的催化下,水解为人体可吸收的葡萄糖。
催化剂一部分是单一化合物,还有一部分是混合物。催化剂种类繁多,按催化效果可分为正催化剂和负催化剂;按状态可分为液体催化剂和固体催化剂;按照反应类型又分为聚合、酯化、加氢、氧化等催化剂;按照作用大小还分为主催化剂和助催化剂。
催化剂在使用时,往往会因接触少量的杂质而使活性明显下降甚至被破坏,这种现象称为催化剂中毒。催化剂中毒分为暂时性中毒和永久性中毒两种。例如,对于合成氨反应中的铁催化剂,O2、CO、CO2等都能使催化剂中毒,但利用纯净的氢气、氮气混合气体通过中毒的催化剂时,催化剂的活性能够恢复,因此这种中毒是暂时性中毒。相反,含某些元素的化合物则可能使催化剂永久性中毒,中毒后,会完全失去活性,催化剂的活性就很难恢复。催化剂中毒会严重影响生产,工业上为防止催化剂中毒,需要将反应物原料加以净化,除去“毒物”,这样就需要增加设备,提高成本。因此,研制具有较强抗毒能力的催化剂,是一个非常重要的课题。
催化剂是现代化学中关键而神奇的物质之一,在现代化学工业中占有极其重要的地位,大多数的化工生产过程中均采用催化剂,以加快反应速率,提高生产效率。

本作品为“科普中国-科学原理一点通”原创,转载时务请注明出处。


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助