30多年来,全球科学家的不懈探索将人类对艾滋病病毒的理解推向更远,也催生出了许多非常有潜力的新药物和新疗法。
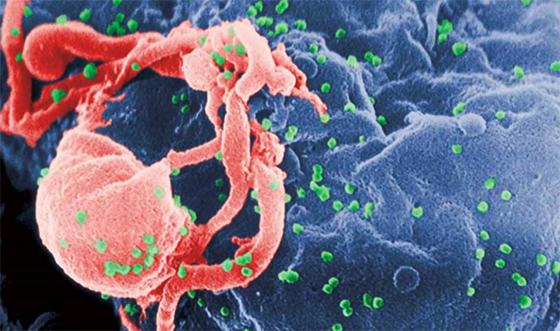 未来50年,哪种灾难最可能造成超过1亿人死亡?数年前,曾有人向加拿大皇家科学院院士瓦茨拉夫·斯米尔(Vaclav Smil)提出这个问题。此前,斯米尔试图评估人类在未来面临突发性大灾难的可能性,因此人们非常期待斯米尔的回答。不过,他最终给出的答案,让很多人感到意外:最可能引发此类灾难的,不是一场世界大战,或是超级火山爆发,也不是小行星撞击地球,而是一场大流感。流感是可以致命的,1918年的西班牙大流感是人类历史上最悲痛的一幕。流感病毒像野火一样蔓延,夺走了无数人的生命。对于人类来说,流感病毒最不好对付的一面就是,它们总在不断发生变异、重组,玩着“变装”的把戏。然而,与艾滋病毒(HIV)相比,流感病毒只能算是小巫见大巫。全球疫苗免疫联盟(GAVI Alliance)总裁塞斯·伯克利(Seth Berkley)曾这样比喻,“与HIV的变异本领相比,流感病毒只能算是直布罗陀海峡中的一块岩石”。自1983年法国科学家首次分离出HIV毒株以来,科学家与HIV之间的较量一直没有停止。这期间,我们取得过短暂的胜利——比如,1996年问世的鸡尾酒疗法就能在一定程度上抑制HIV的复制,但遗憾的是,安全有效的疫苗和治愈方法始终未能问世。不过,科学家从未放弃。现在,曙光正在慢慢浮现,近年来的一些重要研究,或许就是这场抗艾战役的突破口。RV144疫苗疫苗是防治传染性疾病的有效手段。全球共有1 000多个实验室研制过几十种HIV疫苗,但只有3种疫苗完成了Ⅲ期临床实验。其中,RV144是迄今为止唯一一个似乎有些保护作用的疫苗。RV144由美国和泰国科学家联合研制,是用重组金丝雀痘病毒作为载体表达HIV基因片段的疫苗,和其他病毒载体疫苗没有本质区别。2009年发布的临床试验结果显示,接种了这种疫苗的自愿者的HIV感染率降低了31.2%——这也是传染类疾病疫苗预防作用的最低门槛。“虽然效果平平,但这是一个希望的信号”,很多科学家都如此认为,因此,不少科学家也在不断改进RV144。目前,“艾滋病疫苗试验网络”(HIV Vaccine Trials Network,HVTN)正在南非研发一种改良型RV144疫苗,新疫苗称为HVTN 097。为了激发更强更持久的免疫保护,升级版疫苗使用了一种不同的佐剂,并且采用了免疫增强策略,自愿者接种疫苗一年后,将会再次接种。研究人员需要证明改良后的疫苗的安全性,以及疫苗的保护时间是否可以延长。一开始研究人员担心,疫苗在南非的效果会不如泰国,因为泰国人体形明显苗条很多,但I期临床试验表明,尽管南非女性自愿者超过一半属于超重或肥胖,接种改良型疫苗后,出现的免疫反应多数与泰国临床试验的情况类似,一些案例甚至好于泰国临床试验。如果正在进行的一轮大规模临床试验进展顺利的话,2016年底或2017年初将进行最后一次临床试验,届时将有7 000名自愿者参与进来。“只要疫苗的有效性能达到50%,就能扭转当前的抗艾形势,改变游戏规则。”“艾滋病疫苗试验网络”非洲项目主管格伦达·格雷(Glenda Grey)说。除了研制新的疫苗,科学家也希望在基础科学方面,不断推进人类对HIV的认识,从而为疫苗研制提供新的理论依据。比如在2014年10月,美国威尔康奈尔医学院的科学家利用一项新的显微技术,首次观察到了HIV包膜糖蛋白的动态过程,他们发现,病毒表面的蛋白会自己转移,拥有灵活的空间构象。而一般疫苗诱发的抗体的攻击目标,正是HIV的包膜糖蛋白。研究人员认为,这种动态变化使HIV成为一个永远在动的靶位,抗体很难“命中”,这可能就是此前艾滋病疫苗多以失败告终的重要原因。清华大学艾滋病综合研究中心的负责人张林琦认为,既然在某些人群中,HIV可以在8~10年内,甚至终身不发病,这说明人体本身也许就能抵抗HIV,只是尚未找到破解的命门。也许,随着研究的不断深入和细化,科学家最终能找到HIV的致命弱点。分子药物与疫苗研制的艰难历程相比,针对HIV的药物已经取得了一些成功。到目前为止,全球至少有30种抗HIV药物已经获批上市。把这些药物正确搭配起来使用,能够有效控制病毒复制,甚至可以让感染者的血液中检测不到HIV。过去,患者需同时服用多种药物,随着临床试验的深入研究,目前已经上市了多种只需一天一片的固定剂量复合剂(fixed-dose combination,FDC),很大程度上简化了HIV治疗。这类复合剂是在考虑配伍禁忌、药物释放等多种问题的前提下,把多种活性成分压制在一片药物或胶囊里制成。比如,2006年上市的新药Atripla,包含三种抗逆转录病毒药物;2012年上市的Stribild包含一种整合酶抑制剂、一种药代动力学增强剂,以及两种逆转录酶抑制剂;2014年上市的Triumeq包含了一种整合酶链转移抑制剂和两种核苷类逆转录酶抑制剂。除了上述相对“传统”的药物,大量新型药物也处于研发中。其中一类候选新药会以人体细胞和HIV中的某些特殊蛋白为作用目标。以HIV颗粒上的Nef蛋白为例,研究人员早就发现,Nef蛋白能增强病毒颗粒的传染性,但具体机制一直不明了。最近的发现表明,Nef的作用可能是抑制人体细胞包膜糖蛋白SERINC的活性。由于需要一部分感染细胞包膜糖蛋白来建造它自己的包膜,新形成的HIV会携带被感染细胞的包膜糖蛋白SERINC,而在病毒试图感染另一个细胞时,SERINC就会充当一个报警信号,从而降低病毒颗粒的传染性。而病毒Nef蛋白的作用,就是阻止SERINC蛋白整合到新形成的病毒颗粒中。因此,从理论上说,不论是抑制Nef蛋白,还是保护SERINC蛋白,都可以阻止HIV扩散到新细胞。尽管HIV新药研发已有较大规模和高度创新性,但由于HIV药物通常具有不小的副作用,长期用药,药物的毒力、耐药株的产生以及代谢性并发症等可能还是难以避免,因此包括“鸡尾酒疗法”发明者何大一在内的许多科学家急切希望,能找到一种长效预防药物,作为疫苗问世之前的过渡性方案。长效型抗HIV药物GSK744LA就是何大一的最新探索。这个新药由艾伦·戴蒙德艾滋病研究中心联合葛兰素史克和杜兰国家灵长类研究中心共同开发,是一种长效整合酶抑制剂。2015年1月,《科学》(Science)杂志报道了关于这一药物的研究。在这项研究中,科学家在雌猴的阴道接种了高剂量的猴/人类免疫缺陷病毒[SHIV,一种结合了人类免疫缺陷病毒(HIV)基因组和猴免疫缺乏病毒(SIV)基因组的病毒]。结果显示,在试验第一阶段(1~2周),受到GSK744LA保护的雌猴(试验组)无一感染,而没有使用GSK744LA的对照组却无一幸免;在试验第二阶段(5~7周),试验组的8只雌猴中仍有6只未感染病毒。而在稍早前的另一项研究中,研究人员已经证明,GSK744LA能保护通过直肠接种较低剂量SHIV的雄猴长达10周。这说明,至少在动物试验中,GSK744LA具有较好的保护效果,可以做为一种暴露前预防用药(preexposure prophylaxis,PrEP)。何大一认为,由于猴子对该药物的代谢更快,GSK744LA在人类中的有效时间应该更长,能提供3~6个月的保护。现在,GSK744LA已进入更进一步的临床试验,接受更严苛的考验。广谱中和抗体近年来,科学家注意到,10%~30% 的 HIV 感染者在被感染几年后,会产生一种“广谱中和抗体”(broadly neutralizing antibodies, bNAbs),它们可以捕获多种病毒株。2009年,美国斯克里普斯研究所的丹尼斯·R·伯顿(Dennis R. Burton)和同事一起,从一名女性感染者的血清中分离出两种能中和70%以上HIV毒株的抗体。这一发现使bNAbs迅速变成HIV研究中最热门的方向之一。现在,研究人员已经找到近百种bNAbs,有的“明星”抗体甚至能中和98%的HIV毒株,比如I0E8。bNAbs通常识别的是HIV病毒包膜糖蛋白表面的一些保守表位(即病毒变异时,这一区域发生变异程度非常小),这就好像病毒换了衣服,但依旧穿着同样的短袜,而bNAbs就可以瞄着这个不变的特征,找到并消灭病毒。不过,在感染者体内,病毒总是不断变异,逃避抗体追捕,等到感染者体内免疫系统产生bNAbs时,则往往为时已晚。于是,研究人员开始思考,如果尽早将bNAbs注射入感染者体内,是否会带来不同的效果。美国洛克菲勒大学的免疫学家米歇尔·努森兹威格(Michel Nussenzweig)带领团队研发的广谱中和抗体新药3BNC117,是第一款进入临床试验的此类药物。3BNC117能对抗80%以上的HIV毒株,它的靶点是HIV-1包膜糖蛋白gp120表面的CD4结合位点。由于人体细胞上的CD4受体是HIV进入细胞的必经之道,因此对于HIV来说,这一位点非常重要,在进化上也相对保守。努森兹威格团队发表在2015年4月《自然》(Nature)上的I期临床试验结果表明,3BNC117表现出良好的耐受性和药代动力学效果。8名接受最高剂量注射(30mg/Kg)的感染者,体内病毒数量连续4周显著持续下降;在8周研究期结束时,病毒载量仍低于起始水平。“HIV非常聪明,一段时间后,它会对单一药物产生药耐性,对单一抗体可能也会产生耐药性,应对的方法是使用多种抗体,现在我们正在研究,是否需要2~3种抗体联合使用,”论文作者之一莎拉·施莱辛格(Sarah Schlesinger)说。就在最近,努森兹威格团队已经开启了对另一种抗体10-1074的临床试验。针对bNAbs的研究,也为新型HIV疫苗带来了希望——如果能诱导未感染个体的免疫系统生成bNAbs,或许就能阻断感染。一些科学家已经在这方面取得了一些进展。几个月前,威尔康奈尔医学院的约翰·摩尔(John Moore)和同事将一种模拟HIV包膜糖蛋白gp160天然构象的三聚体蛋白注入兔子和猴子体内,结果这种三聚体可以诱导出一定水平的中和抗体来对抗HIV,不过这种抗体可提供的保护力有限。斯克里普斯研究所的威廉·席夫(William Schief)领导的研究小组则采用了另一种思路。他们设计出了一种基于HIV包膜糖蛋白的纳米颗粒,试验显示,这种免疫原能促进经过基因修饰的小鼠B细胞产生一些抗体“前体”。科学家认为,上述两种方法结合起来也许会产生更好的效果。尽管这些方法还未直接促成艾滋病疫苗的研制,但它们极大提升了研究人员的信心。利用广谱中和抗体研发疫苗的思路,还可以帮助科学家发明对付其他病毒的疫苗,相关研究已经超出HIV研究领域,并催生了一个新的学科——还原接种疫苗学。基因疗法作为全球首例且唯一一名被(功能性)治愈的艾滋病患者,蒂莫西·雷·布朗(Timothy Ray Brown)也被称为“柏林病人”。2006年和2007年,布朗的主治医生两次使用一名具有CCR5突变基因(CCR5共受体是HIV进入细胞的另一道门,病毒不能与突变后的CCR5结合,也就无法进入细胞)的捐赠者的骨髓,不仅治好了布朗的白血病,也成就了艾滋病治疗史上的一段传奇。“柏林病人使我们对基因突变和人体的免疫反应有了更深的认识,为我们打开了一扇新的门。”宾夕法尼亚大学的助理教授布鲁斯·莱文(Bruce Levine)说。受到布朗的启发,科学家开始思考,既然CCR5基因发生突变的细胞能抵御HIV的感染,又不失正常的免疫功能,那么,能否通过基因疗法,敲除患者细胞中的CCR5基因,使细胞对HIV产生抵抗力呢?桑加莫生物技术公司(Sangamo Biosciences)开发出的一种“基因剪刀”——锌指核酸酶(ZFN,一种人工改造的核酸内切酶,可在DNA特定位点进行定点剪切),使这些想法能够付诸实战。目前,宾夕法尼亚大学阿博拉姆逊癌症中心的卡尔·朱恩(Carl June)团队和桑加莫公司联合研发的基因疗法SB-728-T,已经进入II期临床试验的末期,这也是第一次将基因编辑技术用在人类身上。研究人员从12名自愿者体内提取未被感染的辅助性T细胞,进行基因改造,敲除CCR5基因后,再向每位自愿者回注100亿个改造后的细胞。4周后,12名自愿者被分成两组,一组停止服用抗逆转录病毒药物12周,另一组继续服药。结果发现,停止服药的试验组中,有4名自愿者体内病毒数下降,其中一名自愿者甚至检测不到病毒。朱恩认为,“这项研究表明,我们能够安全有效地模仿自然发生的CCR5基因突变,改造后的辅助性T细胞能在感染者中断药物治疗后,持续控制病毒载量”。不过,辅助性T细胞只能在病人身上存活数年,因此需要反复进行移植。如果能直接修改患者的干细胞基因,或许会是一种更理想的疗法。因为随着干细胞的增殖,人体就可以迅速建立一个能抵御HIV的全新的血液和免疫系统。今年上半年,桑加莫公司已经与美国希望之城国家医学中心及南加利福尼亚大学凯克医学中心合作,开展干细胞基因疗法的研究。一项名为SB-728-HSPC的疗法已经进入临床试验,预计2016年完成I期临床试验。从桑加莫公司官网上公布的日程来看,2020年将进入II期临床试验。现在,艾滋病可能治愈,已逐渐成为艾滋病研究领域的共识。基因疗法或许将是治愈艾滋病的关键一步。HIV激活剂在鸡尾酒疗法发明后不久,科学家就发现,一些HIV会以DNA的形式潜藏进辅助性T细胞的基因组,鸡尾酒疗法无法对其产生作用。随后,研究人员又发现,HIV还会感染其他类型的免疫细胞,如树突状细胞、单核细胞、巨噬细胞等,甚至还可以通过血脑屏障进入被感染者的大脑。艾滋病患者只要停止服药,这些潜藏病毒就会复苏,因此数量巨大的潜藏病毒一直是治愈HIV的最大障碍。近两三年来,研究人员发现某些治疗癌症的药物,比如伏立诺他、帕比司他、罗米地辛等,能激活感染者体内休眠的HIV,使辅助性T细胞中的HIV复制水平提升至正常水平的数倍。这些病毒激活剂的发现,激发了一种治疗艾滋病的新思路:用病毒库激活剂激活辅助性T细胞内的休眠病毒,让它们进入血液循环,再用广谱中和抗体消灭进入血液的HIV。这种疗法被形象地称为“摄杀法”。去年4月,努森兹威格领导的研究团队,对人源化小鼠模型(经过基因修饰后,带有人类免疫细胞)分别施用抗逆转录病毒药物、广谱中和抗体、病毒库激活剂,以及上述3类药剂的组合。结果显示,单独接受抗逆转录病毒药物或广谱中和抗体治疗的小鼠,在停药后,病毒水平都出现了反弹;将广谱中和抗体与一种病毒库激活剂结合使用,效果也差不多;而接受广谱中和抗体和3种病毒库激活剂组合疗法的小鼠,在接受治疗3个半月后,病毒水平仍没有出现反弹。这项研究表明,广谱中和抗体和多种病毒激活剂组合使用,可以有效摧毁小鼠体内的病毒潜藏库。“这是首次在动物实验中证实,摄杀法可以有效清除潜藏在宿主细胞基因组中的HIV,”努森兹威格说,“不过,这一方法还处于概念阶段,能否适用于人类患者,还需要更进一步的临床试验。”“对于摄杀法,关键是要找到特异性激活病毒库的方法,”张林琦告诉本刊记者,“如果胡子眉毛一把抓式地盲目激活,可能会引起T细胞功能的严重破坏。”细胞疗法患者感染HIV3个月后,体内98%的HIV会为了逃避杀伤性T细胞(人体有两种重要的免疫细胞,一种是辅助性T细胞,即CD4细胞,主要发挥免疫枢纽的指导作用,相当于“将军”,另一种是杀伤性T细胞,即CD8,主要发挥杀伤病原体的作用,相当于“士兵”)的追杀,发生针对性的变异。最近研究人员发现,在感染3个月后才启动治疗的感染者的病毒潜藏库中,已发生逃逸变异的病毒同样占了绝大多数,而这些病毒正是停药后复发的主要原因。“这说明,激活潜藏病毒只成功了一半,现有的抗逆转录病毒药物仍旧无法杀死激活后的病毒,”美国约翰斯·霍普金斯大学医学院的罗伯特·西利齐安诺(Robert Siliciano)说。所以有必要训练杀伤性T细胞,识别并攻击病毒潜藏库释放的、已发生逃逸变异的病毒。今年1月,西利齐安诺领导的研究团队在《自然》(Nature)发表文章称,只要HIV含有2%未突变的保守表位,经过改造后的杀伤性T细胞就可以识别并清除它们,为艾滋病治疗又增加了一种值得期待的细胞疗法。在西利齐安诺的研究中,研究人员首次从病人机体中分离出杀伤性T细胞,然后用HIV蛋白中的保守表位激活杀伤性T细胞,随后在体外观察反应。结果发现,在病毒蛋白的刺激下,杀伤性T细胞变成了一种高效的免疫武器,能产生广泛、有效的免疫反应。随后,研究人员又在一项小规模动物试验中测试了这种杀伤性T细胞,结果同样显示,在人源化小鼠模型中,经过改造的杀伤性T细胞,会识别未突变的HIV表面蛋白,有效清除被HIV感染的细胞。在某些小鼠体内,杀伤性T细胞甚至可以将病毒水平降至检测不到。“大部分感染者的免疫系统都丧失了识别和摧毁HIV病毒的能力,通过引导杀伤性T细胞识别HIV蛋白的未突变部分,可再度唤醒这种细胞的自然杀伤本能。”西利齐安诺说。除了用保守表位激活,还有一种改造杀伤性T细胞的方法,就是直接通过基因工程手段,将广谱中和抗体“捆绑”在杀伤性T细胞上,这相当于给杀伤性T细胞装上了导弹头。这两种改造方法不仅可作为细胞疗法,也是很值得期待的疫苗研发思路。以治疗为预防在7月于加拿大温哥华召开的国际艾滋病大会上,法国巴斯德研究所的免疫学家阿斯尔·赛斯-西里翁(Asier Sáez-Cirión)报告了一例新的“治疗后控制者”病例:一名出生时便开始服用抗逆转录病毒药物的婴儿,6岁时停止了治疗,然而12年后的今天,她血液中依然检测不到病毒。赛斯-西里翁表示,这名年轻的女性是首个有记录的、停止治疗并且停留在缓解期这么长时间的感染者。尽管算不上真正治愈,但研究人员从中得到了一些启示:在感染之初,向HIV发起强有力攻击,或许能延缓发病,甚至不发病。今年5月,美国国立卫生研究院公布的一项大型临床试验的结果也证明,只要感染者尽早检测和治疗,就可以活得更长、更健康。这项临床试验名为“抗逆转录病毒治疗的战略时机”(Strategic Timing of AntiRetroviral Treatment,START),在35个国家同时开展,共有4 685名自愿者参加。所有自愿者之前都没有接受过抗逆转录病毒治疗。在试验中,一半自愿者从一开始就接受抗逆转录病毒治疗,另一半则按世界卫生组织建议,直到辅助性T细胞数降到一定水平,才开始接受治疗。中期结果显示,第一组感染者最终出现严重病情或死亡的概率比后一组低53%。因为该疗法的益处十分明显,研究人员决定提前结束这项研究,在7月份发布的完整结果中,上述数据已更新为57%。丹麦哥本哈根大学的延斯· D·伦德格伦(Jens D. Lundgren)说:“这是艾滋病研究中的一个重要里程碑,早期治疗显然对HIV感染者有益。”由于有效的艾滋病疫苗和治愈方法仍然处在探索阶段,早检测和早治疗也许是目前最有效的防控策略。作者:《环球科学》记者廖红艳(在本文采写过程中,清华大学艾滋病综合研究中心常务副主任张林琦以及汪桦和周盼盼博士提供了很多建议与意见,在此表示感谢。)转载请注明来自“科普中国”。
未来50年,哪种灾难最可能造成超过1亿人死亡?数年前,曾有人向加拿大皇家科学院院士瓦茨拉夫·斯米尔(Vaclav Smil)提出这个问题。此前,斯米尔试图评估人类在未来面临突发性大灾难的可能性,因此人们非常期待斯米尔的回答。不过,他最终给出的答案,让很多人感到意外:最可能引发此类灾难的,不是一场世界大战,或是超级火山爆发,也不是小行星撞击地球,而是一场大流感。流感是可以致命的,1918年的西班牙大流感是人类历史上最悲痛的一幕。流感病毒像野火一样蔓延,夺走了无数人的生命。对于人类来说,流感病毒最不好对付的一面就是,它们总在不断发生变异、重组,玩着“变装”的把戏。然而,与艾滋病毒(HIV)相比,流感病毒只能算是小巫见大巫。全球疫苗免疫联盟(GAVI Alliance)总裁塞斯·伯克利(Seth Berkley)曾这样比喻,“与HIV的变异本领相比,流感病毒只能算是直布罗陀海峡中的一块岩石”。自1983年法国科学家首次分离出HIV毒株以来,科学家与HIV之间的较量一直没有停止。这期间,我们取得过短暂的胜利——比如,1996年问世的鸡尾酒疗法就能在一定程度上抑制HIV的复制,但遗憾的是,安全有效的疫苗和治愈方法始终未能问世。不过,科学家从未放弃。现在,曙光正在慢慢浮现,近年来的一些重要研究,或许就是这场抗艾战役的突破口。RV144疫苗疫苗是防治传染性疾病的有效手段。全球共有1 000多个实验室研制过几十种HIV疫苗,但只有3种疫苗完成了Ⅲ期临床实验。其中,RV144是迄今为止唯一一个似乎有些保护作用的疫苗。RV144由美国和泰国科学家联合研制,是用重组金丝雀痘病毒作为载体表达HIV基因片段的疫苗,和其他病毒载体疫苗没有本质区别。2009年发布的临床试验结果显示,接种了这种疫苗的自愿者的HIV感染率降低了31.2%——这也是传染类疾病疫苗预防作用的最低门槛。“虽然效果平平,但这是一个希望的信号”,很多科学家都如此认为,因此,不少科学家也在不断改进RV144。目前,“艾滋病疫苗试验网络”(HIV Vaccine Trials Network,HVTN)正在南非研发一种改良型RV144疫苗,新疫苗称为HVTN 097。为了激发更强更持久的免疫保护,升级版疫苗使用了一种不同的佐剂,并且采用了免疫增强策略,自愿者接种疫苗一年后,将会再次接种。研究人员需要证明改良后的疫苗的安全性,以及疫苗的保护时间是否可以延长。一开始研究人员担心,疫苗在南非的效果会不如泰国,因为泰国人体形明显苗条很多,但I期临床试验表明,尽管南非女性自愿者超过一半属于超重或肥胖,接种改良型疫苗后,出现的免疫反应多数与泰国临床试验的情况类似,一些案例甚至好于泰国临床试验。如果正在进行的一轮大规模临床试验进展顺利的话,2016年底或2017年初将进行最后一次临床试验,届时将有7 000名自愿者参与进来。“只要疫苗的有效性能达到50%,就能扭转当前的抗艾形势,改变游戏规则。”“艾滋病疫苗试验网络”非洲项目主管格伦达·格雷(Glenda Grey)说。除了研制新的疫苗,科学家也希望在基础科学方面,不断推进人类对HIV的认识,从而为疫苗研制提供新的理论依据。比如在2014年10月,美国威尔康奈尔医学院的科学家利用一项新的显微技术,首次观察到了HIV包膜糖蛋白的动态过程,他们发现,病毒表面的蛋白会自己转移,拥有灵活的空间构象。而一般疫苗诱发的抗体的攻击目标,正是HIV的包膜糖蛋白。研究人员认为,这种动态变化使HIV成为一个永远在动的靶位,抗体很难“命中”,这可能就是此前艾滋病疫苗多以失败告终的重要原因。清华大学艾滋病综合研究中心的负责人张林琦认为,既然在某些人群中,HIV可以在8~10年内,甚至终身不发病,这说明人体本身也许就能抵抗HIV,只是尚未找到破解的命门。也许,随着研究的不断深入和细化,科学家最终能找到HIV的致命弱点。分子药物与疫苗研制的艰难历程相比,针对HIV的药物已经取得了一些成功。到目前为止,全球至少有30种抗HIV药物已经获批上市。把这些药物正确搭配起来使用,能够有效控制病毒复制,甚至可以让感染者的血液中检测不到HIV。过去,患者需同时服用多种药物,随着临床试验的深入研究,目前已经上市了多种只需一天一片的固定剂量复合剂(fixed-dose combination,FDC),很大程度上简化了HIV治疗。这类复合剂是在考虑配伍禁忌、药物释放等多种问题的前提下,把多种活性成分压制在一片药物或胶囊里制成。比如,2006年上市的新药Atripla,包含三种抗逆转录病毒药物;2012年上市的Stribild包含一种整合酶抑制剂、一种药代动力学增强剂,以及两种逆转录酶抑制剂;2014年上市的Triumeq包含了一种整合酶链转移抑制剂和两种核苷类逆转录酶抑制剂。除了上述相对“传统”的药物,大量新型药物也处于研发中。其中一类候选新药会以人体细胞和HIV中的某些特殊蛋白为作用目标。以HIV颗粒上的Nef蛋白为例,研究人员早就发现,Nef蛋白能增强病毒颗粒的传染性,但具体机制一直不明了。最近的发现表明,Nef的作用可能是抑制人体细胞包膜糖蛋白SERINC的活性。由于需要一部分感染细胞包膜糖蛋白来建造它自己的包膜,新形成的HIV会携带被感染细胞的包膜糖蛋白SERINC,而在病毒试图感染另一个细胞时,SERINC就会充当一个报警信号,从而降低病毒颗粒的传染性。而病毒Nef蛋白的作用,就是阻止SERINC蛋白整合到新形成的病毒颗粒中。因此,从理论上说,不论是抑制Nef蛋白,还是保护SERINC蛋白,都可以阻止HIV扩散到新细胞。尽管HIV新药研发已有较大规模和高度创新性,但由于HIV药物通常具有不小的副作用,长期用药,药物的毒力、耐药株的产生以及代谢性并发症等可能还是难以避免,因此包括“鸡尾酒疗法”发明者何大一在内的许多科学家急切希望,能找到一种长效预防药物,作为疫苗问世之前的过渡性方案。长效型抗HIV药物GSK744LA就是何大一的最新探索。这个新药由艾伦·戴蒙德艾滋病研究中心联合葛兰素史克和杜兰国家灵长类研究中心共同开发,是一种长效整合酶抑制剂。2015年1月,《科学》(Science)杂志报道了关于这一药物的研究。在这项研究中,科学家在雌猴的阴道接种了高剂量的猴/人类免疫缺陷病毒[SHIV,一种结合了人类免疫缺陷病毒(HIV)基因组和猴免疫缺乏病毒(SIV)基因组的病毒]。结果显示,在试验第一阶段(1~2周),受到GSK744LA保护的雌猴(试验组)无一感染,而没有使用GSK744LA的对照组却无一幸免;在试验第二阶段(5~7周),试验组的8只雌猴中仍有6只未感染病毒。而在稍早前的另一项研究中,研究人员已经证明,GSK744LA能保护通过直肠接种较低剂量SHIV的雄猴长达10周。这说明,至少在动物试验中,GSK744LA具有较好的保护效果,可以做为一种暴露前预防用药(preexposure prophylaxis,PrEP)。何大一认为,由于猴子对该药物的代谢更快,GSK744LA在人类中的有效时间应该更长,能提供3~6个月的保护。现在,GSK744LA已进入更进一步的临床试验,接受更严苛的考验。广谱中和抗体近年来,科学家注意到,10%~30% 的 HIV 感染者在被感染几年后,会产生一种“广谱中和抗体”(broadly neutralizing antibodies, bNAbs),它们可以捕获多种病毒株。2009年,美国斯克里普斯研究所的丹尼斯·R·伯顿(Dennis R. Burton)和同事一起,从一名女性感染者的血清中分离出两种能中和70%以上HIV毒株的抗体。这一发现使bNAbs迅速变成HIV研究中最热门的方向之一。现在,研究人员已经找到近百种bNAbs,有的“明星”抗体甚至能中和98%的HIV毒株,比如I0E8。bNAbs通常识别的是HIV病毒包膜糖蛋白表面的一些保守表位(即病毒变异时,这一区域发生变异程度非常小),这就好像病毒换了衣服,但依旧穿着同样的短袜,而bNAbs就可以瞄着这个不变的特征,找到并消灭病毒。不过,在感染者体内,病毒总是不断变异,逃避抗体追捕,等到感染者体内免疫系统产生bNAbs时,则往往为时已晚。于是,研究人员开始思考,如果尽早将bNAbs注射入感染者体内,是否会带来不同的效果。美国洛克菲勒大学的免疫学家米歇尔·努森兹威格(Michel Nussenzweig)带领团队研发的广谱中和抗体新药3BNC117,是第一款进入临床试验的此类药物。3BNC117能对抗80%以上的HIV毒株,它的靶点是HIV-1包膜糖蛋白gp120表面的CD4结合位点。由于人体细胞上的CD4受体是HIV进入细胞的必经之道,因此对于HIV来说,这一位点非常重要,在进化上也相对保守。努森兹威格团队发表在2015年4月《自然》(Nature)上的I期临床试验结果表明,3BNC117表现出良好的耐受性和药代动力学效果。8名接受最高剂量注射(30mg/Kg)的感染者,体内病毒数量连续4周显著持续下降;在8周研究期结束时,病毒载量仍低于起始水平。“HIV非常聪明,一段时间后,它会对单一药物产生药耐性,对单一抗体可能也会产生耐药性,应对的方法是使用多种抗体,现在我们正在研究,是否需要2~3种抗体联合使用,”论文作者之一莎拉·施莱辛格(Sarah Schlesinger)说。就在最近,努森兹威格团队已经开启了对另一种抗体10-1074的临床试验。针对bNAbs的研究,也为新型HIV疫苗带来了希望——如果能诱导未感染个体的免疫系统生成bNAbs,或许就能阻断感染。一些科学家已经在这方面取得了一些进展。几个月前,威尔康奈尔医学院的约翰·摩尔(John Moore)和同事将一种模拟HIV包膜糖蛋白gp160天然构象的三聚体蛋白注入兔子和猴子体内,结果这种三聚体可以诱导出一定水平的中和抗体来对抗HIV,不过这种抗体可提供的保护力有限。斯克里普斯研究所的威廉·席夫(William Schief)领导的研究小组则采用了另一种思路。他们设计出了一种基于HIV包膜糖蛋白的纳米颗粒,试验显示,这种免疫原能促进经过基因修饰的小鼠B细胞产生一些抗体“前体”。科学家认为,上述两种方法结合起来也许会产生更好的效果。尽管这些方法还未直接促成艾滋病疫苗的研制,但它们极大提升了研究人员的信心。利用广谱中和抗体研发疫苗的思路,还可以帮助科学家发明对付其他病毒的疫苗,相关研究已经超出HIV研究领域,并催生了一个新的学科——还原接种疫苗学。基因疗法作为全球首例且唯一一名被(功能性)治愈的艾滋病患者,蒂莫西·雷·布朗(Timothy Ray Brown)也被称为“柏林病人”。2006年和2007年,布朗的主治医生两次使用一名具有CCR5突变基因(CCR5共受体是HIV进入细胞的另一道门,病毒不能与突变后的CCR5结合,也就无法进入细胞)的捐赠者的骨髓,不仅治好了布朗的白血病,也成就了艾滋病治疗史上的一段传奇。“柏林病人使我们对基因突变和人体的免疫反应有了更深的认识,为我们打开了一扇新的门。”宾夕法尼亚大学的助理教授布鲁斯·莱文(Bruce Levine)说。受到布朗的启发,科学家开始思考,既然CCR5基因发生突变的细胞能抵御HIV的感染,又不失正常的免疫功能,那么,能否通过基因疗法,敲除患者细胞中的CCR5基因,使细胞对HIV产生抵抗力呢?桑加莫生物技术公司(Sangamo Biosciences)开发出的一种“基因剪刀”——锌指核酸酶(ZFN,一种人工改造的核酸内切酶,可在DNA特定位点进行定点剪切),使这些想法能够付诸实战。目前,宾夕法尼亚大学阿博拉姆逊癌症中心的卡尔·朱恩(Carl June)团队和桑加莫公司联合研发的基因疗法SB-728-T,已经进入II期临床试验的末期,这也是第一次将基因编辑技术用在人类身上。研究人员从12名自愿者体内提取未被感染的辅助性T细胞,进行基因改造,敲除CCR5基因后,再向每位自愿者回注100亿个改造后的细胞。4周后,12名自愿者被分成两组,一组停止服用抗逆转录病毒药物12周,另一组继续服药。结果发现,停止服药的试验组中,有4名自愿者体内病毒数下降,其中一名自愿者甚至检测不到病毒。朱恩认为,“这项研究表明,我们能够安全有效地模仿自然发生的CCR5基因突变,改造后的辅助性T细胞能在感染者中断药物治疗后,持续控制病毒载量”。不过,辅助性T细胞只能在病人身上存活数年,因此需要反复进行移植。如果能直接修改患者的干细胞基因,或许会是一种更理想的疗法。因为随着干细胞的增殖,人体就可以迅速建立一个能抵御HIV的全新的血液和免疫系统。今年上半年,桑加莫公司已经与美国希望之城国家医学中心及南加利福尼亚大学凯克医学中心合作,开展干细胞基因疗法的研究。一项名为SB-728-HSPC的疗法已经进入临床试验,预计2016年完成I期临床试验。从桑加莫公司官网上公布的日程来看,2020年将进入II期临床试验。现在,艾滋病可能治愈,已逐渐成为艾滋病研究领域的共识。基因疗法或许将是治愈艾滋病的关键一步。HIV激活剂在鸡尾酒疗法发明后不久,科学家就发现,一些HIV会以DNA的形式潜藏进辅助性T细胞的基因组,鸡尾酒疗法无法对其产生作用。随后,研究人员又发现,HIV还会感染其他类型的免疫细胞,如树突状细胞、单核细胞、巨噬细胞等,甚至还可以通过血脑屏障进入被感染者的大脑。艾滋病患者只要停止服药,这些潜藏病毒就会复苏,因此数量巨大的潜藏病毒一直是治愈HIV的最大障碍。近两三年来,研究人员发现某些治疗癌症的药物,比如伏立诺他、帕比司他、罗米地辛等,能激活感染者体内休眠的HIV,使辅助性T细胞中的HIV复制水平提升至正常水平的数倍。这些病毒激活剂的发现,激发了一种治疗艾滋病的新思路:用病毒库激活剂激活辅助性T细胞内的休眠病毒,让它们进入血液循环,再用广谱中和抗体消灭进入血液的HIV。这种疗法被形象地称为“摄杀法”。去年4月,努森兹威格领导的研究团队,对人源化小鼠模型(经过基因修饰后,带有人类免疫细胞)分别施用抗逆转录病毒药物、广谱中和抗体、病毒库激活剂,以及上述3类药剂的组合。结果显示,单独接受抗逆转录病毒药物或广谱中和抗体治疗的小鼠,在停药后,病毒水平都出现了反弹;将广谱中和抗体与一种病毒库激活剂结合使用,效果也差不多;而接受广谱中和抗体和3种病毒库激活剂组合疗法的小鼠,在接受治疗3个半月后,病毒水平仍没有出现反弹。这项研究表明,广谱中和抗体和多种病毒激活剂组合使用,可以有效摧毁小鼠体内的病毒潜藏库。“这是首次在动物实验中证实,摄杀法可以有效清除潜藏在宿主细胞基因组中的HIV,”努森兹威格说,“不过,这一方法还处于概念阶段,能否适用于人类患者,还需要更进一步的临床试验。”“对于摄杀法,关键是要找到特异性激活病毒库的方法,”张林琦告诉本刊记者,“如果胡子眉毛一把抓式地盲目激活,可能会引起T细胞功能的严重破坏。”细胞疗法患者感染HIV3个月后,体内98%的HIV会为了逃避杀伤性T细胞(人体有两种重要的免疫细胞,一种是辅助性T细胞,即CD4细胞,主要发挥免疫枢纽的指导作用,相当于“将军”,另一种是杀伤性T细胞,即CD8,主要发挥杀伤病原体的作用,相当于“士兵”)的追杀,发生针对性的变异。最近研究人员发现,在感染3个月后才启动治疗的感染者的病毒潜藏库中,已发生逃逸变异的病毒同样占了绝大多数,而这些病毒正是停药后复发的主要原因。“这说明,激活潜藏病毒只成功了一半,现有的抗逆转录病毒药物仍旧无法杀死激活后的病毒,”美国约翰斯·霍普金斯大学医学院的罗伯特·西利齐安诺(Robert Siliciano)说。所以有必要训练杀伤性T细胞,识别并攻击病毒潜藏库释放的、已发生逃逸变异的病毒。今年1月,西利齐安诺领导的研究团队在《自然》(Nature)发表文章称,只要HIV含有2%未突变的保守表位,经过改造后的杀伤性T细胞就可以识别并清除它们,为艾滋病治疗又增加了一种值得期待的细胞疗法。在西利齐安诺的研究中,研究人员首次从病人机体中分离出杀伤性T细胞,然后用HIV蛋白中的保守表位激活杀伤性T细胞,随后在体外观察反应。结果发现,在病毒蛋白的刺激下,杀伤性T细胞变成了一种高效的免疫武器,能产生广泛、有效的免疫反应。随后,研究人员又在一项小规模动物试验中测试了这种杀伤性T细胞,结果同样显示,在人源化小鼠模型中,经过改造的杀伤性T细胞,会识别未突变的HIV表面蛋白,有效清除被HIV感染的细胞。在某些小鼠体内,杀伤性T细胞甚至可以将病毒水平降至检测不到。“大部分感染者的免疫系统都丧失了识别和摧毁HIV病毒的能力,通过引导杀伤性T细胞识别HIV蛋白的未突变部分,可再度唤醒这种细胞的自然杀伤本能。”西利齐安诺说。除了用保守表位激活,还有一种改造杀伤性T细胞的方法,就是直接通过基因工程手段,将广谱中和抗体“捆绑”在杀伤性T细胞上,这相当于给杀伤性T细胞装上了导弹头。这两种改造方法不仅可作为细胞疗法,也是很值得期待的疫苗研发思路。以治疗为预防在7月于加拿大温哥华召开的国际艾滋病大会上,法国巴斯德研究所的免疫学家阿斯尔·赛斯-西里翁(Asier Sáez-Cirión)报告了一例新的“治疗后控制者”病例:一名出生时便开始服用抗逆转录病毒药物的婴儿,6岁时停止了治疗,然而12年后的今天,她血液中依然检测不到病毒。赛斯-西里翁表示,这名年轻的女性是首个有记录的、停止治疗并且停留在缓解期这么长时间的感染者。尽管算不上真正治愈,但研究人员从中得到了一些启示:在感染之初,向HIV发起强有力攻击,或许能延缓发病,甚至不发病。今年5月,美国国立卫生研究院公布的一项大型临床试验的结果也证明,只要感染者尽早检测和治疗,就可以活得更长、更健康。这项临床试验名为“抗逆转录病毒治疗的战略时机”(Strategic Timing of AntiRetroviral Treatment,START),在35个国家同时开展,共有4 685名自愿者参加。所有自愿者之前都没有接受过抗逆转录病毒治疗。在试验中,一半自愿者从一开始就接受抗逆转录病毒治疗,另一半则按世界卫生组织建议,直到辅助性T细胞数降到一定水平,才开始接受治疗。中期结果显示,第一组感染者最终出现严重病情或死亡的概率比后一组低53%。因为该疗法的益处十分明显,研究人员决定提前结束这项研究,在7月份发布的完整结果中,上述数据已更新为57%。丹麦哥本哈根大学的延斯· D·伦德格伦(Jens D. Lundgren)说:“这是艾滋病研究中的一个重要里程碑,早期治疗显然对HIV感染者有益。”由于有效的艾滋病疫苗和治愈方法仍然处在探索阶段,早检测和早治疗也许是目前最有效的防控策略。作者:《环球科学》记者廖红艳(在本文采写过程中,清华大学艾滋病综合研究中心常务副主任张林琦以及汪桦和周盼盼博士提供了很多建议与意见,在此表示感谢。)转载请注明来自“科普中国”。
版权归原作者所有,如有侵权,请联系我们


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助