2019年诺贝尔奖将于10月7日开始公布,第一个公布的奖项就是生理学或医学奖。
为什么我们这么关注诺奖?
最重要的原因,我想就是它对科研的巨大影响力。
举个例子,我是一名从事干细胞研究的科研人员,自从2012年日本京都大学的山中伸弥教授凭借“多能干细胞(iPS)”获得医学生理学奖之后,日本各个领域的科研人员、产业界、医药界、医院等都将多能干细胞领域放在了主要的研究领域。可见,一个诺贝尔奖足以引发近乎台风效应的风潮。也就是说,每年的诺贝尔奖的获得者的研究领域,会很大程度影响研究人员尤其是年轻科研人员接下来的研究取向。因而,对于我们科研人员而言,每年10月除了翘首期盼国庆长假外,更重要的事情是关心今年哪位科学家又可以喜提诺贝尔医学生理奖。

(图片来源:http://kukkuri.jpn.org/boyakikukkuri2/log/eid1269.html)
而且这个奖项涉及的领域往往和大家的健康比较相关,因此关注度也很高,已经有不少朋友在问我,觉得今年会是谁获奖。
其实,我怎么觉得不重要,诺奖评审委员会怎么觉得才重要呀!
不过作为一名科研工作者,当然心里也是有一些自己的判断的,它们不一定能拿诺奖,但它们在我的心中,都是“诺奖级”的成果。
2019年9月24日,科睿唯安(Web of Science Group)公布了获得2019年度“引文桂冠奖”的19位科学家,这19位科学家也会是今年诺贝尔奖的有力候选人。接下来,我就(大胆地)根据“引文桂冠奖”的获奖名单,对今年的诺贝尔奖生理学奖做一个预测。以往的得奖热门国家——我们的邻国日本这次并没有入选“引文桂冠奖”,但根据对以往预测结果的分析,本文也同时关注了此次可能获奖的日本候选人。

(图片来源: https://zhuanlan.zhihu.com/p/83921229)
预测一:森和俊,日本京都大学大学院理学研究科教授。
理由:“检出了内质网(ER:endoplasmic reticulum)内存在的特有蛋白质,并独自发现了这些蛋白质的修复机制”。
内质网是细胞内的一系列重要的生物大分子,是合成蛋白质、脂类(如甘油三酯)和糖类的基地。而这个内质网有一个系统(内质网压力应答反应),用于管理细胞的品质。在1988年,森教授实验室发现,当细胞状况不佳时,内质网中会产生越来越多的物质,由此对内质网中错误蛋白的"检测和修复"分子机制的研究才真正开始。当细胞缺乏氧气或营养,或者感染病毒,基因变异,产生炎症等压力下,内质网会蓄积大量的错误蛋白质。这些错误蛋白质的过度蓄积使得内质网处于压力的状态,导致细胞发生细胞凋亡,进而影响到机体组织的功能不全,并引发各种疾病。。这里,森教授发现在内质网中存在修复和处理这些错误蛋白质的机制,这种机制被称为“未折叠蛋白反应”(unfolded protein response),内质网通过发动这个反应以尝试排除错误蛋白以改善细胞的状态,并发现了相关的管理这些机制的基因。该机制被认为与糖尿病、动脉硬化和帕金森病有关,正在被世界各地用于致病原因调查和治疗方法的研究。因此,2009年森教授获得了加拿大国际医学奖“加拿大盖特纳国际大奖”,这个奖自1959年创设以来,每4个人中就有1个人获得了诺贝尔奖。加之在2015年,森教授就被评为诺贝尔奖有力的候选人,我们推测,森教授是今年诺贝尔生理学或医学奖的有力候补人之一。
预测二: 汉斯·克拉弗斯(Hans Clevers),荷兰乌得勒支大学分子遗传学教授。
理由:“首次将Wnt信号与成年干细胞生物学联系起来,创造了出色的体外疾病模型”。
汉斯·克拉弗斯教授是第一位在肠道中鉴定干细胞的人,并且是世界领先的正常干细胞和干细胞研究者之一。克拉弗斯教授的团队一直从事肠道和肠道生理方面的最为基础的研究,在这个肠道领域中,有成千上万的研究胃癌,结肠炎或克罗恩氏病的胃肠病学家,但很少有实验室研究正常组织,而克拉弗斯教授却着眼于这些正常的组织。如下图,绒毛是小肠壁的手指状突起,为了吸收营养,小肠内的绒毛使得小肠具有最大化可利用的吸收表面积。每个绒毛的底部都被多个上皮细胞包围,这些凹陷的部位称之为隐窝。
肠道正常组织是正常人体中增殖最快的组织。他的研究团队在肠道的隐窝处鉴定出了肠道中的干细胞。他发现Wnt(细胞中的重要信号传导途径)信号和这些隐窝干细胞的自我更新有关,即Wnt信号为干细胞室提供燃料,使得干细胞不断的增殖,以维持正常的肠功能,而失调的wnt信号则成为结肠癌的主要驱动器。他用这个干细胞建立了各种体外杰出的模型,为研究肠道癌症等疾病提供了基础。
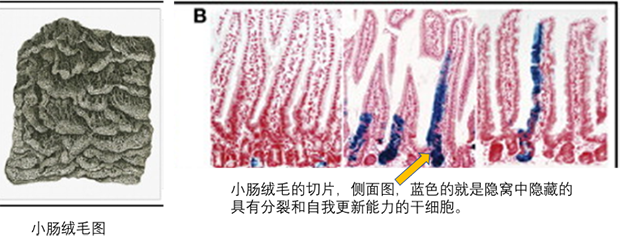
(图片来源:https://www.sciencedirect.com/science/article/pii/S0092867413008386#bib2)
2004年他获得了路易斯·让埃特医学奖,同时也是今年引文桂冠奖的获得者。因此我们推测,汉斯·克拉弗斯教授是强有力的候补者之一。
预测三:约翰·卡普尔John W. Kappler,美国国家犹太健康中心综合免疫学系的教授及他的妻子Philippa Marrack,美国国家犹太健康中心综合免疫学系的教授。
理由:“在T细胞研究领域的杰出贡献”。
免疫学一直是医学界一直以来最为关注的领域之一。约翰·卡普尔与妻子Philippa Marrack合作,主要的研究领域是T细胞生物学。1983年,他们发现了T细胞受体。
T细胞(T cell)是一种淋巴细胞,在骨髓中产生的前体细胞通过胸腺的选择而分化并成熟。T细胞占外周血淋巴细胞的70-80%。细胞表面的特征蛋白是T细胞受体(T细胞受体; TCR)。名字"T"来自Thymus,意思是胸腺。T细胞在免疫系统中扮演重要的角色,T细胞不仅防止感染,而且驱动自身免疫和过敏性疾病。如下图所示,T细胞在对抗恶性肿瘤细胞方面发挥重要的作用。卡普尔教授为理解T细胞关键的抗原特异性反应及相关分子如何参与免疫识别做出了重要贡献。例如,他们研究了带有表面抗原CD4的T细胞与一型糖尿病的关系。他们也研究T细胞受体与其靶向抗原在不同条件下的相互作用,目的是了解为什么自身免疫性疾病和过敏只发生在某些个体,并改进癌症疫苗。
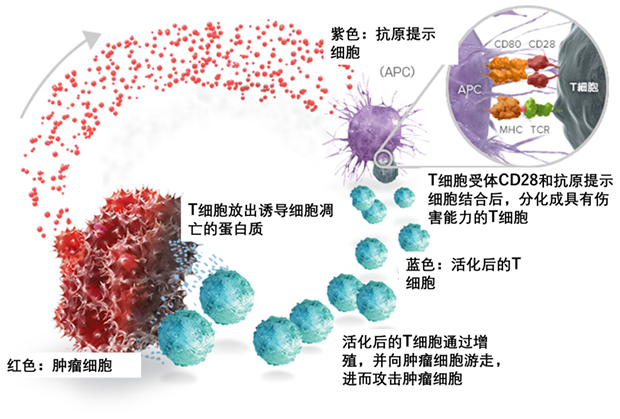
T细胞攻击癌细胞的原理示意图
(图片来源:http://www.immunooncology.jp/medical/immune-system/central-t-cell.html)
2015年,卡普尔教授获得了沃尔夫医学奖。沃尔夫医学奖每年评选一次,被认为是科学界第二负盛名的奖项,也是诺贝尔奖的重要预测指标之一。因此,我们预测约翰·卡普尔教授和她的妻子很有可能获得本次诺贝尔奖。

Philippa Marrack教授和 John W. Kappler教授
(图片来源 https://www.nationaljewish.org/research-science/programs-depts/biomedical-research/labs/kappler-marrack-research-lab/overview)
预测四:恩斯特·班伯格Ernst Bamberg,德国法兰克福马克斯普朗克生物物理研究所名誉所长;
Karl Deisseroth,美国加利福尼亚州斯坦福大学霍华德休斯医学研究所研究员,生物工程和精神病学与行为科学D.H. Chen杰出教授;
Gero Miesenb?ck,英国牛津大学神经回路和行为中心主任兼生理学Waynflete教授。
理由:“感光色素蛋白的功能分析,在基础光遗传学领域的贡献”
恩斯特·班伯格教授的研究集中在微生物感光色素蛋白的功能分析、光通道、相关运输蛋白的研究上。尤其是在通道视紫红质方面,他们第一个分离并鉴定了二型离子通道视紫质(CHR2)。
首先解释什么是光遗传学,利用遗传学(例如转基因动物杂交等)的手段,使得感光蛋白质(如绿藻中含有的视紫红质)在特定的细胞中表达,通过光刺激来调控细胞活动的技术。如下图所示,通道视紫质是光敏感蛋白中的离子通道,当用青色光刺激时,它就会在细胞膜上形成一个开口的离子通道,利用这个原理,利用转基因的手段,将这个蛋白插入到神经或者肌肉细胞中,利用光激活细胞。举个简单的例子,将这个ChR2导入大脑中和运动相关的细胞中,用光照射后,细胞被激活,就会诱导四肢的运动。在帕金森病的研究中,利用这个手段发现了和帕金森病相关的重要脑回路调控蛋白。
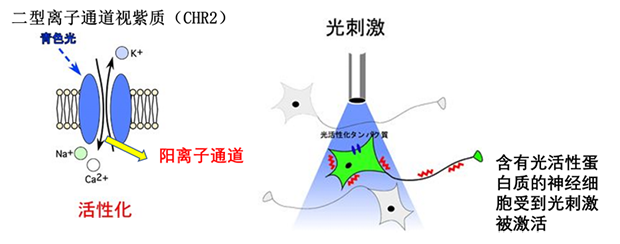
(图片来源:https://bsd.neuroinf.jp/wiki/%E5%85%89%E9%81%BA%E4%BC%9D%E5%AD%A6#.E5.A4.89.E7.95.B0.E5.9E.8BChR2)
班伯格教授团队以及其他两位教授新开发的一些改进的光敏感蛋白通道在全球范围内被用于基础神经生物学研究、生物医学应用和药物发现。2005年,他们证明这一光门通道可以被用作致动器以控制神经活动,这些研究帮助奠定了基础光遗传学研究。光遗传学的研究一时间成为了科学家的宠儿,并引起了神经科学领域爆发性的发展。为人类和神经相关的疾病科学上的分析做出了重要贡献。恩斯特·班伯格教授等三位教授,我们也推测他们是此次2019年诺贝尔医学生物学奖的热门人选。
参考资料:
https://zhuanlan.zhihu.com/p/48319782
https://www.nationaljewish.org/research-science/programs-depts/biomedical-research/labs/kappler-marrack-research-lab/overview
https://www.biophys.mpg.de/en/bamberg.html
https://zhuanlan.zhihu.com/p/83921229
Clevers, H. The intestinal crypt, a prototype stem cell compartment.Cell. 154: 274-284 (2013)


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助