恶性肿瘤是人类健康的重大威胁,化疗作为肿瘤治疗的三大传统方法之一,在临床抗肿瘤应用中仍然捉襟见肘。一是其毒副作用大,“杀敌一千,自毁八百”,另一方面,化疗后肿瘤清除不彻底,易耐药,易复发的特点也极大限制了化疗疗效。
癌细胞:化疗,是杀不死我的
一直以来,化疗不能完全杀死癌细胞是让医者和患者都抓狂的问题。化疗是利用细胞毒性药物阻止癌细胞的增殖、浸润、转移,直至最终杀灭癌细胞的一种治疗方式。其作用机制可分为:直接作用于DNA、干扰DNA和核酸合成、阻碍有丝分裂、影响蛋白质合成、作用于肿瘤信号转导机制等。研究中利用的化疗药阿霉素是DNA拓扑异构酶Ⅱ的抑制剂,通过嵌合到DNA的鸟嘌呤-胞嘧啶碱基对之间,使碱基对的距离由原来的0.34 nm增大至0.68 nm,从而引起DNA的裂解,属于直接作用于DNA的药物。
正常状况下,阿霉素破坏了癌细胞的DNA后会诱导细胞凋亡,但是在TP53野生型的癌细胞中,化疗却诱导其进入衰老状态,并分泌一系列衰老相关分泌表型的细胞因子和趋化因子,从而可以增强癌细胞功能,例如增殖、存活、肿瘤干性、免疫逃逸、肿瘤耐药和转移。
为何本该杀灭肿瘤细胞的化疗药物却诱导产生这种不利治疗的行为呢?
太残忍!为了活命癌细胞竟互相残杀
使用RNA测序和基因集富集分析小鼠乳腺肿瘤病毒MMTV-Wnt1肿瘤,MCF-7(人源乳腺癌细胞系)和4226(由TP53野生型MMTV-Wnt1肿瘤构建的鼠源乳腺癌细胞系)发现,细胞周期相关基因的表达高度富集,这与化疗诱导的细胞周期停滞相一致。此外,化疗后的癌细胞中与吞噬有关的基因标记变得丰富,说明化疗可能会诱导癌细胞获得吞噬的能力。
近期的一篇研究报道证实,癌细胞的“卷土重来”与其吞噬相邻细胞有关,让我们来了解一下癌细胞“为求自保,同类相食”的具体发现。

该研究成果发表在JCB上(图片来源:http://jcb.rupress.org/content/early/2019/09/16/jcb.201904051)
为了研究乳腺肿瘤中癌细胞的相互作用,研究人员用荧光对p53野生型MMTV-Wnt1肿瘤进行标记。利用化疗药物阿霉素诱导癌细胞增殖停滞和衰老后,在小鼠乳腺肿瘤或乳腺癌细胞系中,均观察到细胞叠套(cell-in-cell)结构:化疗诱导的衰老细胞内部形成大的囊泡,这些囊泡源自培养物或肿瘤中的其他邻近细胞。即,癌细胞“吃”掉了其他的相邻细胞。
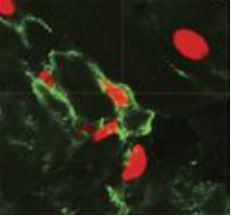

小鼠肿瘤(左)和4226细胞系(右)中的衰老癌细胞吞噬其它细胞(图片来源:http://jcb.rupress.org/content/jcb/early/2019/09/16/jcb.201904051/F1.large.jpg)
被吃的细胞会面临怎样的命运?
使用SA-βGAL(细胞衰老标记)和绿色荧光标记的LAMP1(溶酶体膜的成分)发现,衰老细胞的溶酶体区室广泛扩展,被吞噬的细胞被包裹在溶酶体膜内,证实其被加工成溶酶体后降解。
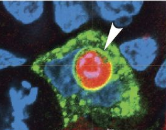
被吞噬的细胞加工成溶酶体
(图片来源:http://jcb.rupress.org/content/jcb/early/2019/09/16/jcb.201904051/F4.large.jpg)
显微镜观测结果显示,衰老细胞能够完全吞噬相邻细胞,并将其在2-3天内降解,也有部分残留物在囊泡中存在长达一周时间。此外,癌细胞吞噬邻近细胞不止发生一次,还可以“连环作案”,吞噬多个细胞。被吞噬的细胞被加工成溶酶体后降解,为肿瘤生长和复发提供了能量和材料。
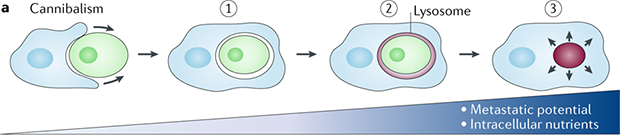
同类相食为癌细胞提供营养
(图片来源:https://www.nature.com/articles/s41568-018-0073-9/figures/2)
用阿霉素诱导MCF-7和4226细胞衰老,7天后发现发生了同类相食的细胞存活时间均比未吞噬的细胞长,这些数据表明细胞吞噬增强了衰老癌细胞的生存能力。
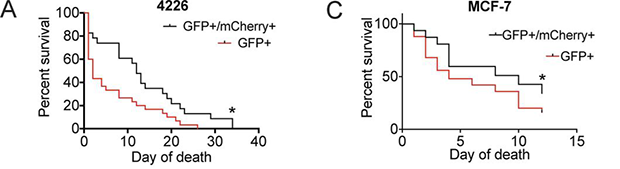
吞噬了邻近细胞的癌细胞具有更强的生存能力
(图片来源:
http://jcb.rupress.org/content/jcb/early/2019/09/16/jcb.201904051/F8.large.jpg)
值得一提的是,癌细胞并非一接触化疗药物就开始同类相食,而是会蛰伏一段时间:一般在诱导细胞衰老后的第4天发生吞噬,并在第6天达到最高水平。
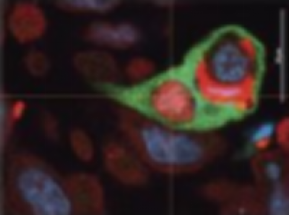

衰老的癌细胞吞噬多个邻近细胞(左)和已吞噬了细胞的癌细胞(右)
(图片来源:http://jcb.rupress.org/content/jcb/early/2019/09/16/jcb.201904051/F2.large.jpg)
所有的癌细胞都会同类相食吗?
实际上,肿瘤组织中的细胞套叠(cell in cell)的结构早在一百多年前就被发现,并被认为不利于癌症治疗。在化疗诱导下,吞噬作用的发生率大幅提高,鼠源乳腺癌4226细胞的吞噬率为14%至23%,人源乳腺癌MCF-7细胞为16%至25%,而未经处理的细胞吞噬率约为3-4%。那么仅乳腺癌细胞在化疗后会产生同类相食的行为吗?答案是否定的,研究人员发现人非小细胞肺癌A549和人骨肉瘤U2OS细胞也出现了类似吞噬同类的情况,说明同类相食的行为广泛存在于多种类型的癌细胞中。

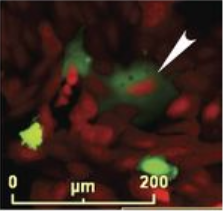
肺腺癌细胞(左)和骨肉瘤细胞(右)也存在同类相食的状况
(图片来源:http://jcb.rupress.org/content/jcb/early/2019/09/16/jcb.201904051/F3.large.jpg)
经分析发现,观测到发生同类相食行为的癌细胞,均为TP53野生型(野生型表明基因是自然存在,并不是由突变产生),这表明,TP53基因可能是导致同类相食的“关键基因”。也就意味着,如果癌细胞中含有TP53基因,则会发生同类相食。
那么TP53基因为何如此神通广大?TP53基因能够编码p53蛋白,p53蛋白是一种细胞转录因子,当存在活性p53时,乳腺癌细胞化疗后就不会死亡而是衰老,再蓄势待发,卷土重来,使得化疗失败。
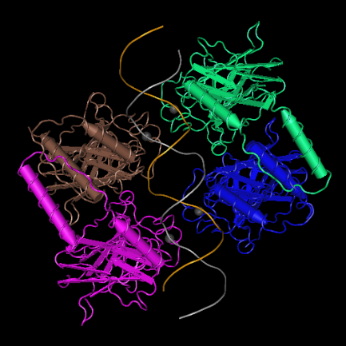
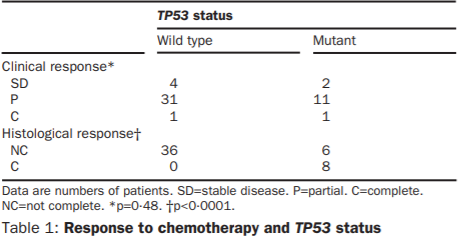
p53结构(上) TP53与化疗效果的关系(下)
(图片来源:https://www.ncbi.nlm.nih.gov/Structure/pdb/4MZR
https://doi.org/10.1016/S0140-6736(02)09969-5)
没嘴没牙,癌细胞是如何“吃”掉同类的?
细胞吞噬的两种模式是细胞侵入性死亡也称内陷(entosis)和吞噬作用(phagocytosis):内陷是细胞主动被邻近细胞摄取,吞噬作用则是主动进攻去吞噬相邻细胞。
那么癌细胞的同类相食究竟采用的是何种战术呢?研究人员发现,虽然阿霉素处理后的单层细胞的吞噬率增加了5-10倍,但是其内陷的发生率并未提高;阻断了内陷的过程后,吞噬效率未受影响;与内陷过程紧密相关的钙粘附蛋白-E在这个过程中也未增加,且将编码该蛋白的基因敲除后,吞噬效率仍旧居高不下。这就排除了细胞吞食是由内陷介导的。而相反的是,在阿霉素处理后的衰老细胞中,吞噬作用和溶酶体运输水平显著增强,证明了这种癌细胞同类相食的作用机制是吞噬作用。
虽然同类相食与吞噬作用都与细胞表面标记物CD68的表达有关,且两者都涉及肌动蛋白依赖的吞噬活性,但是也有研究人员认为同类相食与吞噬作用仍存在一定的区别,即吞噬作用通常针对垂死或死亡的细胞,而同类相食也可能吞噬活细胞,提示同类相食可能有其独特的机制。
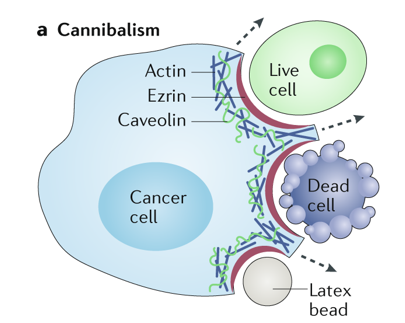
同类相食示意图
(图片来源:https://www.nature.com/articles/s41568-018-0073-9/figures/1)
癌细胞会“吃”同类获得新能力,我们怎么办?
实际上,并非只有化疗会诱导癌细胞同类相食,有研究表明,高水平的活性氧和电离辐射也诱导出现这种现象。既然同类相食有利于癌细胞生存,那么抑制这类吞噬邻近细胞的行为可能会为癌症的治疗提供一种新思路,具有显著的临床意义。例如摄入大量惰性颗粒可能会干扰细胞吞噬,从而剥夺某些癌细胞同类相食的能力,促进癌细胞死亡。进一步深入研究癌细胞同类相食行为,了解经该过程的能量供应特点,有望为肿瘤患者的化疗提供有价值的指导。
参考文献:
1、http://doi.org/10.1083/jcb.201904051
2、https://www.nature.com/articles/s41568-018-0073-9


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助