原标题:糖尿病:糖尿病:过去、现在和未来(完结):新地平线
好了读者们,故事讲到现在也就快到了要和大家说再见的时候。在过去的章节里,我和大家一起,重走了一遍人们理解自身的身体、理解糖尿病、与糖尿病顽强战斗的历史。希望看到这里,读者们对这种困扰人类三千年的疾病有了更丰富的理解,对糖尿病治疗方法背后的科学探索有了更多的敬意。但是我还要说的是,在这些成就之外,我们还不得不承认,糖尿病对于人类而言,仍是一种虽然可以有效控制、但是完全无法治愈的疾病。
班廷广场上的希望火炬还在熊熊燃烧,提醒我们攻克疾病的使命任重道远。
因此在故事的最后,我们不妨来看看科学家、医生和药物开发者们,还在做着什么样的努力。因为这些努力,也许会在不久的未来如旭日东升,为糖尿病治疗照亮新的地平线。
偷梁换柱:移植一个好胰腺
我们已经讲了很多胰岛素的传奇故事。
到今天,胰岛素仍然是一型糖尿病患者和一部分血糖控制效果不好的二型糖尿病患者的首选和救命良药。
而胰岛素注射治疗的问题也是显而易见的。在正常人体内,胰岛素的合成和分泌受到血糖水平的调节,因此能够及时和灵敏地随血糖水平起伏,从而把血糖控制在合理范围内。
虽然,胰岛素药物的化学结构和降血糖功能虽然和人体胰岛素别无二致,但是直接通过注射器进入体内的胰岛素却无法感知和响应血糖水平的细微变化。
也正因为这个原因,胰岛素注射是一项挺有“技术含量”的工作,患者需要相当小心地监测血糖变化,注意用餐的节奏和食物的构成,并相应地注射不同剂量和类型(长效、常规、短效等)的胰岛素。如果稍有错漏后果也许会相当严重。
因此一个显而易见的更优选择是,在一型糖尿病的患者体内偷梁换柱,更换一个功能完好的胰腺,让身体器官自身去控制胰岛素的水平,而不是注射器和针头。
这样的思路倒并非天方夜谭。
实际上早在1966年,医生们就成功实施了第一例异体胰腺移植,将器官捐献者的胰腺成功移植到一位28岁的女性体内。这位女性患有严重的糖尿病和并发症,但是在手术后仅仅数小时,她的血糖水平就出现了显著地下降。
在此之后,医生们也逐渐发展了活体胰腺移植的技术:将活体捐献者的一部分胰腺移植到患者体内,这样就可以摆脱对去世者器官捐献的依赖。
在本世纪初,医生们还更进一步地发明了胰岛移植的技术,只需要将捐献者的胰岛细胞输入胰腺,就可以部分地恢复胰岛素分泌的功能,这样的手术自然是比移植完整胰腺要简单的多了。
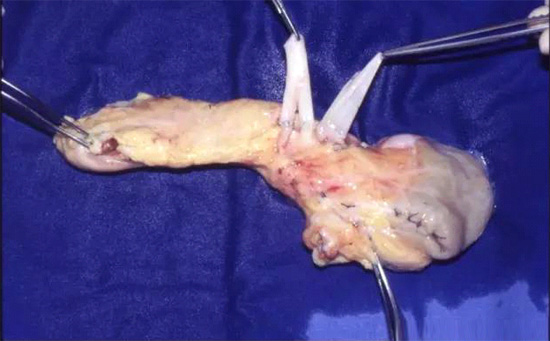
进行中的胰腺移植
图中显示的是从尸体中取出,经过体外血管再造,将要被植入患者体内的完整胰腺。经过几十年的技术发展,胰腺移植已经是非常成熟的手术操作了,每年有数以千计的患者接受胰腺移植(来自尸体捐献者)或部分胰腺移植(来自活体捐献者)。手术的预后情况也相当理想。唯一的重要问题是,接受胰腺移植的患者和所有器官移植患者一样,需要终生服用免疫抑制药物,从而大大增加了各种感染性疾病的发病概率。(图片来自英文维基百科)
这几类胰腺“移植”的手术在过去的半个世纪已经成功地挽救了上万名严重糖尿病病人的生命。
但是胰腺“移植”的努力最终会撞上一面叫做“异体排斥”的墙。
简单来说,我们身体里的免疫系统的主要功能就是区分“自己”和“异己”,随后攻击“异己”保护“自己”。因此移植到体内的(他人的)胰腺也好,胰岛也好,马上会被免疫系统盯上并攻击,从而导致器官衰竭和死亡。
也因为这个原因,所有接受胰腺和胰岛移植的病人都需要终身服用抑制免疫功能的药物,而免疫功能遭到抑制会让人暴露在难以计数的病原体的威胁之下。
从某种意义上,接受器官移植的患者必须生活在某种密闭的玻璃盒子里,因为外面的世界对他们而言实在是太危险了。
另起炉灶:再造一个新胰腺
那有没有可能不走器官移植的老路,干脆另起炉灶,人工“制造”出一个胰腺呢?
听起来很美,难度也是显而易见的。
先不说全人工制造的器官了,这个目前为止还更多的是科幻作品的内容。比如人类制造的能部分替代肺功能的呼吸机、能部分实现血液透析功能的人工肾等等,目前的体积和构造都还没有一点点“人类”的影子,更不要说放到体内治疗疾病了。
一个容易点儿的思路可能是利用人体细胞重建人体器官,这个方案至少理论上可以借助大自然这个“搬运工”。
要知道,我们身体里的所有器官,当然也包括胰腺在内,都是从一个名叫受精卵的细胞分裂而来的。因此从一个能够分裂增殖的人体细胞(我们一般叫它“干细胞”/stem cell)制造出一个功能完整的胰腺倒并非天方夜谭。
但是尽管如此,虽然如今在实验室让干细胞分裂,产生更多的细胞并非难事,但是人类还没有能力在实验室里制造哪怕是一块有完整功能的有机组织。
这里面的原因其实也不难理解:人体的组织有着精密的结构,并非一大堆细胞堆积在一起就能叫做胰腺,别忘了我们讲过胰腺的构造,腺泡细胞和胰岛细胞功能迥异,但是结构上包裹在一起,而胰岛内具有多种细胞,包括分泌胰高血糖素的阿尔法细胞和分泌胰岛素的贝塔细胞。
这样复杂的构造是在十月怀胎的发育过程中缓慢形成的,要想在实验室里完整地模拟真是谈何容易!
为了跨越这个从单个细胞到成形组织之间的天堑,至少可以有两个不同方向的策略。
第一个办法是,放弃幻想,不要奢望能制造出一个和天然胰腺从内到外都不差分毫的胰腺了。干脆想办法用人体细胞制造一个哪怕难看一点,但是足够好用的人工胰腺就行。
人们在这方面其实倒是已经有一些技术的积累了。
比如说读者们可能听说过的人造耳朵的故事。科学家们可以用某种人工材料造出一个“支架”(可以是钛合金,也可以是某种容易降解的人工材料),之后将干细胞“接种”上去,经过一段时间的悉心培育,细胞就能布满整个支架表面并形成耳朵模样的结构了。
当然我们要知道,人造耳朵并不需要什么复杂的结构和功能,它的发明很大程度上是为了美观的需要,而人们制造胰腺却是指望它能精准分泌胰岛素的!
即便如此,在新的地平线上我们还是能看到一些曙光。比如说,美国一家名为Viacyte的公司开发了一种人工胰腺,至少能在某种程度上模拟出胰岛素分泌的功能来。
这家公司的技术原理说来也简单,他们利用人体的胚胎干细胞在培养皿里进行定点培养,让这种细胞大量分裂并分化,之后将这些细胞装在一个几厘米长的小盒子里植入皮下,这么一个人工“胰腺”就完成了。
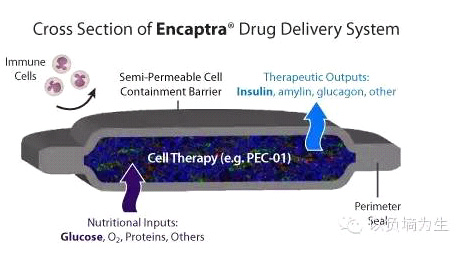
Viacyte公司的革命性产品Encaptra的工作原理
简单来说,Encaptra就是制造一个容器,使得蛋白质和血糖小分子能够通过,而细胞无法通过,并在里面接种上能够分泌胰岛素的贝塔细胞。这个容器植入身体之后,贝塔细胞就可以监测身体的血糖变化,同时灵敏地调节胰岛素分泌。与此同时,这个容器一方面能够防止贝塔细胞流失,一方面阻止了人体免疫细胞的进入。目前,Encaptra正在接受临床试验。(图片来自www.viacyte.com)
拜托,这么个白色的小盒子哪里像胰腺啊?
确实不像,而且实际上开发者们也没有打算让它“像”。他们唯一在乎的就是这种小装置能否分泌胰岛素。
实际上这种名为VC-01的技术带来的震撼是颠覆性的。白色的小盒子里装载的细胞在在植入人体后,能够在体内各种环境的刺激下最终成为贝塔细胞,从而能够合成和分泌胰岛素。
更重要的是,这个看起来普通的白色小盒子其实四面都是细密的滤网,具有很好的透过性,能让类似于氧气、血糖、蛋白质的分子进出盒子,因此盒子里的细胞能像真正的贝塔细胞那样密切监测血糖水平并调节胰岛素分泌,而胰岛素分子也可以顺利地逃出盒子在身体各处发挥作用。
怎么样,听起来不错吧?

Viacyte公司的副总裁麦克.斯科特(Michael Scott)手持Encaptra的容器,名为PC-01。我们可以看到,PC-01体积很小,仅有几厘米长。(图片来自www.geneticsandsociety.org)
别急。肯定有读者会发现里面的问题:你刚刚讲过“异体排斥”的问题,说“别人家”的器官会引发免疫反应甚至导致死亡。可是Viacyte这个白色小盒子里装的,应该也是别人家的细胞吧?是不是也会引起严重免疫反应呢?如果是这样的话,这种技术好像也不高明嘛。
没错,确实是别人家的细胞。
Viacyte用到的胚胎干细胞目前还只能从“别人家”来(除非患者出生的时候保留了脐带血干细胞,这样的话也许可以用自己本人的细胞)。
但是这个不简单的白色小盒子还有一个重要的功能,它四面滤网上的滤孔直径很小,能够允许几纳米大的蛋白质、血糖这样的分子通过,但是不允许几微米大的细胞通过。因此人体的免疫系统根本没有机会进入盒子接触到里面“别人家”的细胞,因此也就成功的避免了免疫反应的发生。
怎么样,听起来是不是确实很巧妙?
第二个办法听起来就更巧妙了。
既然异体移植导致的免疫反应总是一个需要面对和解决的问题,那干脆看看能不能把身体里的一部分多余细胞变成胰腺贝塔细胞吧,这样的细胞是如假包换的“自己的”细胞,绝对不需要担心异体排斥的问题。
而这个办法背后的挑战也是巨大的。
要知道,人类身体中的各种功能细胞,从负责胰岛素分泌的贝塔细胞、看见世界的视网膜细胞,到专门负责长发飘飘的生发细胞,虽然都是从一个受精卵分裂而来,携带着一模一样的遗传信息,但是不管从位置上还是从长相上都差异悬殊。而这种悬殊的差异背后是细胞内成千上万蛋白质分子的差异化功能,也意味着在任意两种细胞类型之间转换是非常困难的。
不过随着人们对细胞分化过程和干细胞生物学的深入研究,在制造“自己家”胰腺的道路上也有了不少闪光的发现。咱们长话短说,就讲在这个方向上做出了重要贡献的一个人吧,道格拉斯.米尔顿(Douglas A Melton)。

道格拉斯.米尔顿
哈佛大学教授,美国科学院院士,两个孩子的父亲。他的两个孩子年幼时都被发现患有一型糖尿病,而这彻底的改变了他的职业生涯:发育生物学家出身的他彻底转向一型糖尿病研究。而这一点,也很有可能会在不久的将来改变整个世界对一型糖尿病的认识和相关的治疗方法。(图片来自www.bostonglobe.com)
米尔顿出生于1953年,早年专注于发育生物学研究。
而当他的一双儿女被发现患有一型糖尿病后,他将全部精力投入到一型糖尿病、特别是如何制造贝塔细胞的研究中。2008年,他的实验室发现只需要操纵三个基因的表达,就可以在小鼠体内将胰腺腺泡细胞转化为胰岛贝塔细胞,架起了一座连接功能迥异的两个细胞类型之间的桥梁,也为治疗一型糖尿病提供了全新的思路。
而在2014年,他的实验室成功地将人体细胞“去分化”成为干细胞,再将它们在体外定向分化成为贝塔细胞。这使得在体外大规模地制造贝塔细胞成为可能,又一次开创了一条通往再造新胰腺的道路。
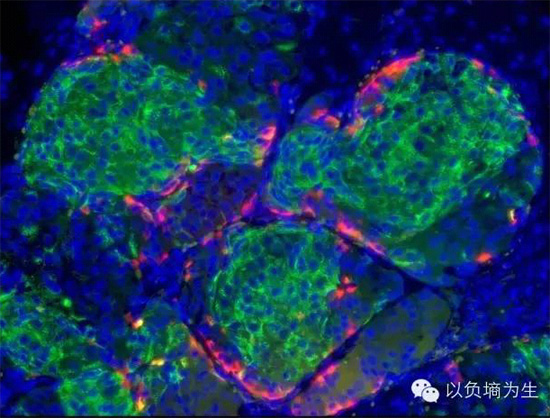
米尔顿实验室2014年的突破性进展
他们成功的将人体细胞在体外“去分化”至干细胞状态后,再定向分化为胰岛贝塔细胞。这些人造的贝塔细胞在小鼠体内能够形成类似胰岛的结构(上图绿色的细胞团簇),响应血糖变化分泌胰岛素,成功的治疗了小鼠的糖尿病。从一定程度上,这等于是在动物体内制造了一个新胰腺。值得提出的是,米尔顿实验室所用的“去分化”干细胞又称iPS细胞(induced pluripotency stem cell/人工诱导的多能干细胞),这项革命性的技术已经获得了2012年诺贝尔奖。(图片来自www.harvardmagzine.com)
寻根问底:找到糖尿病的终极原因
不管是移植一个好胰腺,还是制造一个新胰腺,都有希望成为糖尿病患者的重要治疗方案。但是喜欢寻根问底的读者,也许仍然会觉得不满足。
“我们记得你讲过,一型糖尿病是一种自身免疫疾病,是因为免疫系统杀死了自己的贝塔细胞导致的;二型糖尿病则是代谢疾病,是身体对胰岛素失去响应导致的。可是怎么感觉你讲到的所有方法,不管是胰岛素,还是利拉鲁肽/阿格列汀这些促进胰岛素分泌的药物,还是移植制造胰腺,都像是治标不治本、头痛医头脚痛医脚的办法?就没有办法真的让免疫系统不再攻击贝塔细胞么?就没有办法让机体恢复对胰岛素的响应么?"
不得不说,这都是人们孜孜以求,但却始终没有被完美解答的问题。
先说一型糖尿病吧。
的确,这是一种自身免疫系统功能失调导致的疾病。与之相对应的,人们也发现如果用药物抑制患者的免疫系统,有时候确实能缓解糖尿病的症状。因此在理论上,人们也许可以开发出一种特异性的抑制免疫功能的药物,使其不要再攻击贝塔细胞,但却不会影响免疫系统的正常活动。
不过,身体的免疫系统的功能如何失调,又为何会专门挑贝塔细胞痛下杀手,关于这些问题,我们所知仍然甚少。对于大家刨根问底的询问,我只能遗憾地说“不知道”。
更值得一说的是二型糖尿病。
我们已经知道,二型糖尿病的发病是因为机体(特别是肌肉和肝脏细胞)对胰岛素失去响应导致的。
在疾病的开端,我们的身体会补偿性地分泌更多的胰岛素以实现准确的血糖调节;而在缓慢的发病过程中,胰岛素难以越来越多地分泌,又或是胰岛素响应度的持续下降,最终打破了这个平衡,糖尿病由此产生。
也正因为这个机理,市场上现有的二型糖尿病药物大多是在促进胰岛素分泌或增强胰岛素敏感性两点作文章。比如我们讲过的二甲双胍可以增加胰岛素的敏感性,而另一类主流药物磺脲类的主要作用是促进胰岛素分泌,等等。
但是和一型糖尿病类似的是,我们的的确确,并不是完全了解为什么二型糖尿病患者的身体失去了对胰岛素的响应。
我们甚至也不知道,这些临床上行之有效的药物,究竟是怎样改善症状的。
正因为这许许多多个“不知道”,更有针对性的临床治疗和药物研发,也许其实仍旧处在炼金术时代。
也许,我们仍然需要等待类似于山羊豆能毒死牲畜这样的偶然提示,才找到得到更好的救命药物。
或者,更有尊严地等待,其实是等待来自实验室的科学发现,等待那些探索未知奥秘的科学家们。在过去的一百多年里,胰腺的功能、胰岛素的发现、蛋白质测序、重组DNA技术、蛋白质结构晶体学……正是这些看似和糖尿病完全无关的科学进步最终将糖尿病关在了笼中,从一种可怕的绝症变成可控的慢性疾病。
我们因此也有理由相信,这些努力最终能解答关于我们身体的层层追问,让我们有可能用理性的光照亮黑暗中的病魔,并把它们赶出我们赖以栖身的家园。


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助