联苯胺重排反应即氢化偶氮苯类经σ迁移反应重排为4,4'-二氨基联苯的反应。重排在强酸存在下进行,4,4'-二氨基联苯是主要产物。
简介1862年,Hofmann在还原偶氮苯时得到了联苯胺产物,即4,4'-二氨基联苯( 对联苯胺) ,发现了联苯胺重排反应。从此,开始了对联苯胺重排反应的机理和应用研究。在联苯胺重排反应中,不仅可以生成主产物对联苯胺,在某些条件下还可以得到邻对联苯胺、邻联苯胺、邻半联胺和对半联胺。在Stille和Suzuki偶联反应报道以前,联苯胺重排和Ullmann反应是合成联苯类化合物的重要方法,在合成上得到广泛应用。
联苯胺重排被发现至今已有150年历史,在这150年间,对其重排反应机理研究一直没有中断过,先后提出了极性过渡态理论,π络合物理论,双自由基理论和阳离子自由基对理论,以及环质子化理论。但双自由基和阳离子自由基对理论及环质子化理论由于都没有强有力的和可接受的实验信息支持,基本没有生命力,在此不再做进一步的介绍。
直至20世纪80年代,Shine等通过同位素标记动力学实验才证实了邻联苯胺和对联苯胺的形成是通过[3,3]和[5,5]σ迁移反应实现的。但在联苯胺重排反应中,副产物的形成机理至今仍困扰着有机化学家。在20世纪末就已经确证了邻联苯胺和对联苯胺的形成是通过σ迁移反应实现的,并且国外的教科书也都以σ迁移反应来解释联苯胺重排反应的机理。1
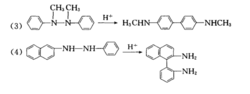
反应特点反应也产生2,2'-和2,4'-二氨基联苯。当对位有不易脱落的取代基时,也产生2-和4-氨基二苯胺。
反应产物和动力学受芳环上取代基的影响。
有些取代基(特别是受电子基)可脱落,容易程度从SO3H,СО2Н>RC(O),Cl>OR递减。
N-叔酰胺RC(O)NR、仲氨基-NR2与烷基不脱落。
重排也可在惰性溶剂与80-130°C的无酸条件下发生(热重排)。溶剂极性越强,重排也越快。不过热重排的区域选择性不如酸催化的重排。
芳环有一个对位被封闭时,重排得对半联苯胺。两个对位都被封闭,则得邻半联苯胺。1
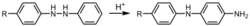
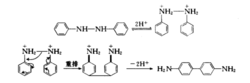
反应是分子内的,用不同的二芳肼进行反应,不得到交叉产物。机理中,首先两个氮被质子化,后发生重排,得到的4,4'-二亚胺联苯再去质子,得产物。12
本词条内容贡献者为:
陈红 - 副教授 - 西南大学Benzidine重排
图文简介
联苯胺重排反应即氢化偶氮苯类经σ迁移反应重排为4,4'-二氨基联苯的反应。重排在强酸存在下进行,4,4'-二氨基联苯是主要产物。
- 来源: 科普中国科学百科
- 上传时间:2018-06-21


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助