过渡金属催化的不对称烯丙基烷基化反应(asymmetric allylic alkylation,简称为AAA反应)是构建手性分子重要的方法之一。该类反应在实现醛、酮、1,3-二羰基化合物的不对称转化中发挥着重要作用。
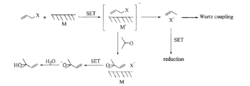
反应机理1994年,chan等人提出了金属催化烯丙基化反应可能的机理。他认为该反应是一个单电子转移的反应。
然而对于烯丙基化锢中间过渡产物的性质却所知甚少,这是由于有机铟化合物极易被水解。Whitesidess,Arkai和chan等人曾对有机锢过渡态化合物做了一些探索并取得了一些进展,但对于这类化合物在反应中存在的确切结构及其性质还不是非常明确,有待于进一步的研究。1
在铟催化的烯丙基化反应中,如果使用简单的醛作为反应底物,则其产物以反式结构产物为主,并且其反式产物的比例随着醛的R基团的增大而增加。这个结果可以通过反应中所形成的六元环状的中间过渡态来解释。
L.A.Paquett和Mori等人对铟催化的烯丙基化反应的立体选择性作了更进一步的研究,他们发现当使用α-或β-羟基醛做为反应底物,在水相介质中,其烯丙基化产物的立体结构主要由水相中羟基和铟通过鳌合作用所形成的鳌合物中间过渡态决定。α-羟基醛在上述条件下发生烯丙基化反应时主要以顺式的产物为主,而β-羟基醛则以反式产物为主。但值得注意的是,当α-或β-羟基被保护时,随着保护基团的增大,其鳌合作用则越弱,反应的立体选择性也就越不明显。1
现状与发展目前AAA反应主要面临着两个挑战:
(1)如何将亲核试剂拓展到α-H酸性较弱的羧酸衍生物;
(2)如何在非环体系中构建季碳手性中心。
实现该类反应的关键是构建立体构型确定的四取代烯醇化物及其羧酸氧化态的等价体。
Evans等人从α-二取代的腈类化合物出发,通过形成N-锂化的前手性阴离子作为羧酸衍生烯醇化物的等价体实现了AAA反应。侯雪龙等人从包含二苯基胺的酰胺出发,经由四取代的烯醇化物实现了AAA过程。Stoltz和Marek等人从炔基氨基甲酸酯类化合物出发,经顺式的碳金属化、氧化以及O-烯丙氧基羰基化生成四取代的O-烯丙氧基羰基烯醇化物,随后经羟基保护、钯催化的脱羧AAA反应生成酰胺α位烯丙基化的产物。尽管目前该领域已经取得了不少的进展,但仍然面临着官能团兼容性较差以及原子经济性不高等局限。1
本词条内容贡献者为:
陈红 - 副教授 - 西南大学烯丙型迁移
图文简介
过渡金属催化的不对称烯丙基烷基化反应(asymmetric allylic alkylation,简称为AAA反应)是构建手性分子重要的方法之一。该类反应在实现醛、酮、1,3-二羰基化合物的不对称转化中发挥着重要作用。
- 来源: 科普中国科学百科
- 上传时间:2018-06-21


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助