炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),是一类由多种病因引起由异常免疫介导的肠道慢性炎症性疾病,且随病情进展全身多器官均可受累。该病发生机制与遗传、环境因素及肠道微生态等交互作用下所致的免疫系统异常激活有关,涉及肿瘤坏死因子-α、白细胞介素(IL)-12/IL-23等多种炎症因子通路,由于其病理生理学机制复杂且具有复发倾向,给临床治疗带来了挑战[1]。
近年来IBD药物治疗领域取得了诸多进步,采用双靶向生物疗法(DBT)、生物制剂-小分子药物联合疗法(BMT)等多种联合治疗策略的临床研究不断涌现。然而,目前关于DBT/BMT方案的安全性证据仍存在诸多局限,如样本量小、随访时间短、缺乏对照、特殊人群数据不足,以及药物相互作用尚未得到系统评估等,导致其长期安全性评价尚不充分。因此,治疗药物的安全性问题仍是临床实践中需重点关注的方向。
乌司奴单抗(UST)是生物制剂的代表药物之一,为一种靶向IL-12/IL-23 p40亚基的全人源单克隆抗体,可通过调节辅助性T细胞1(Th1)/Th17细胞介导的炎症通路而抑制肠道异常免疫反应,已成为中重度IBD的重要治疗选择。
新型Janus激酶1(JAK1)抑制剂乌帕替尼(UPA)可靶向作用于Janus激酶-信号转导及转录激活因子(JAK-STAT)信号通路中的JAK1分子,有助于IBD患者快速且持久地进行症状控制。
上述两种药物治疗IBD的适应证具有一定重叠,可作为联合治疗的一种潜在选择,但其给药方式及作用机制存在差异,联合使用时需进行包括用药安全在内的多维度评估[2-4]。
由于联合用药的安全性评估首先应建立在对各单药安全谱充分了解的基础之上。因此,本研究基于美国食品药品监督管理局不良事件报告系统(FAERS),深入挖掘并分析比较UST与UPA在IBD治疗中相关的药物不良事件(ADE)信号,旨在为临床安全用药提供参考,并为未来联合用药的风险评估积累数据基础。
1 材料与方法
1.1 数据来源
本研究数据来源于FAERS数据库,其为美国FDA建立的用于监测药品和治疗性生物制品上市后安全性的自发报告数据库,可通过收集全球范围内的ADE报告,辅助识别潜在的药物安全风险。通过在线药物警戒工具OpenVigil 2.1版(http://open vigil.sourceforge.net/)规范检索UST及UPA治疗IBD的相关ADE报告。
根据药物最早用于IBD的时间,前者检索时间为2017年第三季度至2025年第一季度,后者为2019年第三季度至2025年第一季度。检索关键词分别为UST通用名“ustekinumab”及商品名“Stelara”联合“inflammatory bowel disease”或“IBD”,“ulcerative colitis”或“UC”,“Crohn's disease”或“CD”,UPA通用名“upadacitinib”及商品名“Rinvoq”联合“inflammatory bowel disease”或“IBD”,“ulcerative colitis”或“UC”,“Crohn's disease”或“CD”。
最终纳入该时间段内以UST及UPA为首要怀疑药物的ADE报告。根据规范的提取方法,采用OpenVigil的字段提取逻辑,ROLE_COD=‘PS’(首要怀疑)且DRUGNAME匹配药物通用名或商品名,确保因果关联强度,并提取患者年龄、性别、治疗结果等基本信息及ADE相关数据。
1.2 数据清洗和标准化
采用《国际医学用语词典》25.1版本,对数据中的ADE描述用语进行标准化处理,具体包括系统器官分类(SOC)和首选术语(PT)[5]。本研究排除了用药错误、药物无效及超说明书使用等相关的PT,结合药品说明书及相关文献报道,对挖掘的潜在ADE进行汇总分析。
通过OpenVigil 2.1获取相关数据,该工具在提取数据时已内置基于FAERS数据库唯一病例标识符(CASEID)的自动去重算法,确保纳入分析的每个案例报告的独立性,有效避免同一患者的多次重复报告对信号挖掘造成的偏倚。对于年龄、性别、体重等患者基本信息中的缺失数据,将其视为“不清楚”这一独立类别,并予以保留进行描述性统计分析。为确保数据客观性,未对缺失值进行删除或插补处理,以真实反映FAERS自发报告数据库的原始特征。
1.3 信号挖掘方法
采用报告比值比(ROR)和比例报告比(PRR)法进行信号挖掘与统计分析。两种方法均基于比例失衡法中的四格表进行计算[6]。PRR法的阳性信号生成条件设定为:报告数≥3,PRR值≥2且χ2值≥4;ROR法的生成条件则为报告数≥3,且其95%置信区间(CI)下限>1[7]。为降低假阳性风险,最终认定的阳性信号须同时满足上述两种方法的判定条件。通常,PRR或ROR的数值越大,表明目标药物与不良事件之间的统计关联性越强,即信号强度越高。具体计算公式详见表1和表2。
表1 基于比例失衡法中的四格表

表2 ROR和PRR计算公式及其阈值

2 结果
2.1 ADE报告基本信息
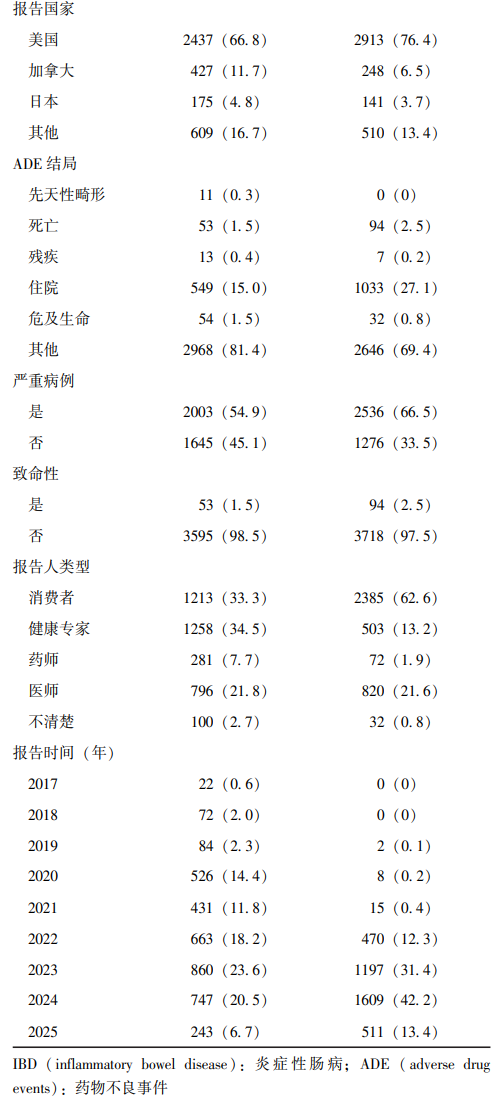
经检索,2017第三季度至2025年第一季度期间,适应证为IBD、以UST为首要怀疑药物的ADE报告共3648份。涉及患者中,女性1800例(49.3%)、男性1448例(39.7%)、不清楚400例(11.0%);各年龄段均有分布,其中18~65岁人群占比最高(46.3%)。2019年第三季度至2025年第一季度期间,适应证为IBD、以UPA为首要怀疑药物的ADE报告共3812份。涉及患者中,女性1738例(45.6%)、男性1669例(43.8%)、不清楚405例(10.6%);患者亦可见于任何年龄段,且18~65岁人群占比最高(35.4%)。提示,采用上述2种药物治疗发生ADE的IBD患者中,女性更为多见,发病年龄高峰为18~65岁。
ADE报告人类型涵盖消费者、健康专家、药师和医师等。其中在UST相关报告中,消费者(33.3%)和健康专家(34.5%)的占比较高;而在UPA相关报告中,消费者(62.6%)和医师(21.6%)为主要报告来源。从报告年份来看,UST相关ADE在2023年(23.6%)和2024年(20.5%)报告数量较多;UPA相关ADE则在2023年(31.4%)和2024年(42.2%)显著增多。ADE结局主要包括先天性畸形、死亡、残疾、住院以及危及生命等,其中以住院最为常见。UST与UPA相关报告中,患者住院率分别为15.0%和27.1%;此外,绝大多数ADE为非致命性,二者的非致命性比例分别为98.5%和97.5%。详见表3。
表3 乌司奴单抗和乌帕替尼治疗IBD的ADE报告基本信息[n(%)]

2.2 ADE信号分析
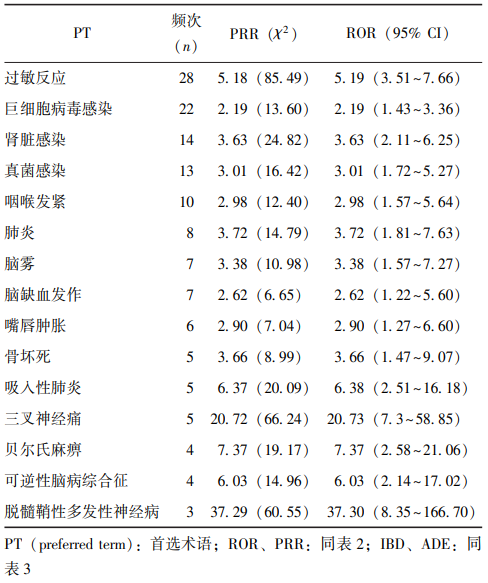
通过ROR与PRR联合检测法筛选出相关的ADE信号。在UST相关的高频ADE报告中,发生频率居前15位的依次为:
过敏反应、巨细胞病毒感染、肾脏感染、真菌感染、咽喉发紧、肺炎、脑雾、脑缺血发作、嘴唇肿胀、骨坏死、吸入性肺炎、三叉神经痛、贝尔氏麻痹、可逆性脑病综合征及脱髓鞘性多发性神经病(表4)。
表4 乌司奴单抗治疗IBD的高频(Top 15) ADE报告
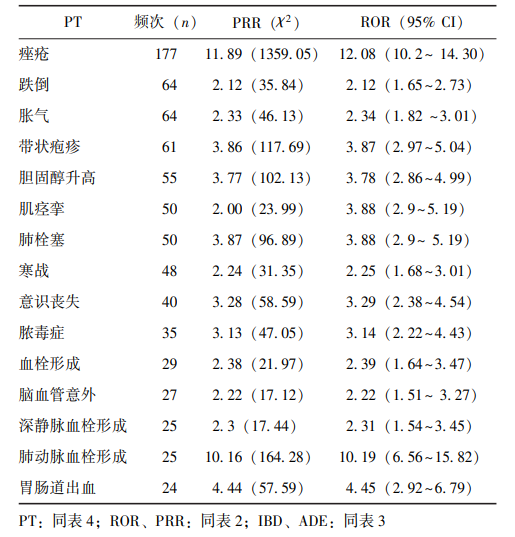
在UPA相关的高频ADE报告中,居前15位的主要包括:痤疮、跌倒、胀气、带状疱疹、胆固醇升高、肌痉挛、肺栓塞、寒战、意识丧失、脓毒症、血栓形成、脑血管意外、深静脉血栓形成、肺动脉血栓形成及胃肠道出血(表5)。
表5 乌帕替尼治疗IBD的高频(Top 15)ADE报告
2.3 ADE累及系统器官
基于SOC对ADE报告阳性信号进行分析,排名居前10位的SOC见表6。
表6 乌司奴单抗和乌帕替尼治疗IBD发生ADE累及的主要SOC [n(%)]
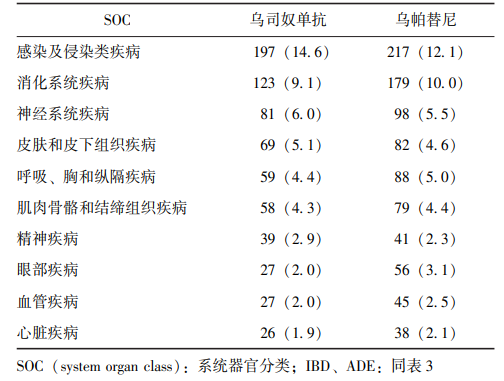
两种药物均以感染及侵染性疾病,消化系统疾病,神经系统疾病,皮肤和皮下组织疾病,呼吸、胸和纵隔疾病为高发SOC类别。进一步对UST和UPA治疗IBD过程中发生ADE所累及的主要SOC及PT进行分析,结果表明感染及侵染类疾病为最主要的SOC,涉及的PT包括埃希菌性脓毒症、肺炎球菌性肺炎等(图1)。
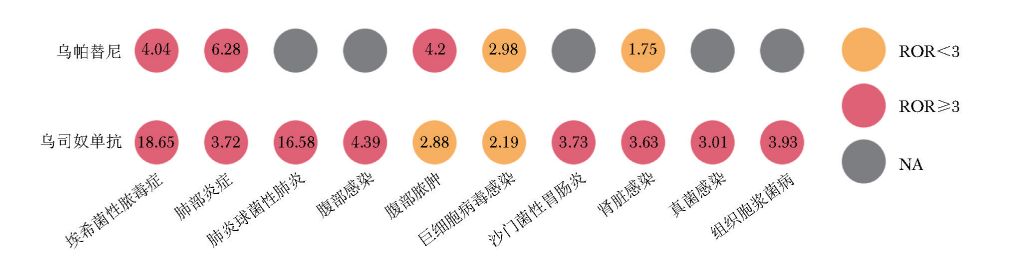
图1 乌帕替尼和乌司奴单抗治疗IBD发生感染ADE累及的主要PT
3 讨论
本研究基于FAERS数据库,对UST和UPA治疗IBD的安全性进行了真实世界药物警戒研究。结果显示,两种药物的安全性特征存在显著差异:UST相关的风险信号主要集中于严重的感染(如巨细胞病毒感染、肺炎球菌性肺炎)、过敏反应及神经系统脱髓鞘事件等方面;而UPA则表现出与痤疮、带状疱疹、血脂异常及严重的血栓栓塞事件具有更强的关联性。
在严重病例结局上,UPA组住院率显著高于UST组。这些发现揭示了两种不同作用机制的药物在IBD治疗中需重点关注的安全性问题,为临床实践提供了重要的风险预警和监测依据。
生物制剂、小分子药物单独使用或与免疫调节等药物联合使用是当前中度或重度IBD患者的推荐治疗方法,其疗效及安全性是近年来研究的热点[8-9]。然而,上述药物联合治疗在给患者带来获益的同时,是否具有潜在的新发ADE亟待明确,而这建立在对每种药物作用机制和不良反应谱充分了解的基础之上。
IL-12/IL-23在肠道稳态和 IBD 的发病机制中起重要作用,UST作为一种人源化单克隆IgG1抗体,能够特异性结合IL-12/IL-23结构中的p40亚基,阻止其与NK细胞或T 淋巴细胞表面高亲和力受体(IL-12Rβ1)相结合,从而抑制细胞因子的信号传导和多种效应细胞的进一步激活,对肠道及肠外炎性反应均有抑制作用,从而缓解IBD病情进展、减轻临床症状[10]。
然而其不良反应不容忽视,依据药物说明书,UST用药常见不良反应包括上呼吸道感染、头痛、注射部位反应、胃肠不适,严重不良反应包括超敏反应(如喉头水肿或皮疹)、胃肠道不适(腹泻、恶心)、感染风险增加(如肺炎或胃肠炎),长期使用可能激活潜伏感染或诱发恶性肿瘤。
本研究对UST治疗IBD发生ADE的情况进行了分析,结果显示发生频率居前15位的不良反应依次为过敏反应、巨细胞病毒感染、肾脏感染、真菌感染、咽喉发紧、肺炎、脑雾、脑缺血发作、嘴唇肿胀、骨坏死、吸入性肺炎、三叉神经痛、贝尔氏麻痹、可逆性脑病综合征、脱髓鞘性多发性神经病。由该数据可知,除说明书报道的过敏反应外,各种感染和肺炎也是UST治疗IBD过程中常见的不良反应,而且该药引起的消化系统疾病、神经系统疾病、肌肉骨骼和结缔组织疾病等其他不良反应也需引起重视。
在临床上,应用UST治疗IBD时,需规范化的用药管理和预防性措施以降低用药过程中的感染风险,定期复查血常规、炎症标志物等指标,出现发热、持续咳嗽、腹泻等感染症状时应及时就医,并在医生指导下定期评估疗效和安全性,避免患者自行调整剂量,以降低不良反应风险。
与UST不同,UPA是第二代选择性JAK1抑制剂,可减少促炎细胞因子IL-4、IL-13、IL-23介导的信号传导,从而减轻肠道炎症,精准调节免疫反应,降低T细胞过度活化所致的组织损伤,促进黏膜愈合,已被多种国际组织相继批准用于治疗对一线治疗无应答的中重度UC和CD[11-12]。UPA说明书指出,发生率相对较高的常见不良反应包括上呼吸道感染、鼻咽炎、带状疱疹和单纯疱疹等,这与该药物的免疫抑制机制有关。此外,还可能出现头痛、痤疮、毛囊炎、荨麻疹、恶心、血肌酸磷酸激酶升高、中性粒细胞减少以及肝酶升高等不良事件。
在严重不良反应方面,主要包括严重感染,例如肺炎、结核再激活和胃肠炎等。长期用药还可能增加机会性真菌或细菌感染的风险。在心血管风险方面,可能增加心肌梗死和卒中的发生风险,尤其是有吸烟史或已有心血管基础疾病的患者用药需慎重。此外,血栓事件以及淋巴瘤、肺癌等恶性肿瘤的发生率也有所上升,尤其老年患者或长期高剂量用药者的相关风险更高。
最新一项来自28个国家187个研究中心的多中心、开放标签、随机对照3b期临床试验显示,UST治疗中重度CD用药24周时临床缓解率为39.5%,主要ADE包括机会性感染、过敏、影响肝功能等[13]。在另一项针对CD的随机对照研究中,UPA 6 mg组治疗16周时27%患者实现了临床缓解,常见ADE包括头痛、CD恶化、急性胰腺炎、疲劳、上呼吸道感染、尿路感染、恶心、呕吐和痤疮[14]。
近期发表的一项研究探究了BMT疗法治疗难治性CD的有效性和安全性。共10例难治性CD患者接受UPA和UST联合治疗,随访10个月时,其中8例(80.0%)患者达到了临床缓解,常见不良反应主要为轻度呼吸道感染症状和恶心[15]。上述研究提示联合治疗方案相比UPA、UST单药对于难治性CD患者可能具备更好的有效性与安全性,二者联合用药有希望成为未来治疗IBD的重要趋势。然而,由于该研究存在病例数有限、单中心设计以及既往UPA单药治疗的不良反应数据较为匮乏,使得该联合方案的安全性尚缺少高质量证据。
本研究结合公共数据库对UPA治疗IBD的不良反应信号进行挖掘分析,结果表明发生频率居前15位的ADE依次为痤疮、跌倒、胀气、带状疱疹、胆固醇升高、肌痉挛、肺栓塞、寒战、意识丧失、脓毒症、血栓形成、脑血管意外、深静脉血栓形成、肺动脉血栓形成、胃肠道出血。对阳性事件进行SOC归类后显示,发生频率较高的类别主要为感染及侵染性疾病、消化系统疾病、神经系统疾病、皮肤和皮下组织疾病、呼吸/胸/纵隔疾病。该发现提示,在临床实践中,除常规不良反应外,还需高度警惕如肺栓塞、脓毒症、各类血栓形成事件及脑血管意外等可能危及生命的严重不良事件。
本研究数据显示,UPA的多项安全性风险数据均高于UST,具体包括严重病例比例(66.5% 比54.9%)、ADE导致住院的比例(27.1% 比15.0%)及ADE致死比例(2.5% 比1.5%)。然而,在解读上述差异时需谨慎。该结果并非表明UPA本身具有更高的安全性风险,而可能受到FAERS数据库作为自发报告系统所固有的偏倚影响,例如报告动机差异、严重事件上报优先、用药人群总数缺失以及适应证混杂等因素。从作用机制上看,UPA作为高选择性JAK1抑制剂,其血栓事件风险升高与JAK1抑制干扰凝血-抗凝平衡及内皮功能密切相关,具体机制涉及多条通路,包括:IL-6/STAT3信号通路异常增强凝血因子活性,抗血栓通路(如IL-10/IFN-β)受抑制,CXCR4-NETs轴被激活,以及内皮修复功能障碍,这些因素共同促进了血栓形成。因此,在IBD治疗中,对使用UPA的高风险人群应加强临床监测,密切观察相关不良反应,适时调整用药剂量,并持续进行用药安全性评估与风险防控。
本研究存在一定局限性:
1、FAERS数据库中的数据来自于自发报告,存在自发报告偏倚,部分不良事件可能未被完整上报,从而影响研究结果的准确性。
2、纳入的ADE报告主要来源于欧美国家,国内相关监测数据较为有限,可能引入种族偏倚。例如,一项关于UPA治疗类风湿关节炎的临床研究显示,亚洲人群中带状疱疹的年发病率约为3.80/100患者年,显著高于白种人群的1.12/100患者年[16],提示种族与地区差异可能影响UPA不良事件研究结果的外推性。
3、FAERS数据库的信息完整度也在一定程度上限制了本研究的深入分析。该数据库未涵盖用药剂量、合并用药及基础疾病等重要混杂因素,可能导致某些ADE信号被高估(例如,血栓事件是否与IBD患者本身的高凝状态相关尚不明确)。同时,由于缺乏充分的分层信息,针对不同特征亚组进行差异化信号挖掘的分析受到限制。
4、在研究方法方面,采用ROR法与PRR法挖掘的ADE信号仅提示药物与目标事件之间存在统计学关联,尚不能确立其因果关系。
综上所述,本研究基于FAERS数据库分别对UPA和UST治疗IBD的不良反应信号进行了挖掘与分析,结果提示UST和UPA在治疗IBD时,需充分掌握适应证,识别高风险人群,并对患者用药后可能出现的感染、心脑血管疾病、深静脉血栓形成、肺动脉血栓形成及胃肠道出血等风险问题进行重点关注,同时加强感染及侵染性疾病、消化系统疾病、神经系统疾病及皮肤和皮下组织疾病等不良反应的监测和管理,定期评估药物疗效和安全性,以降低不良反应发生风险。本研究数据为未来两种药物联合应用提供了更加全面的安全性信息。
来源: 协和医学杂志


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 协和医学杂志
协和医学杂志 

