
1常见细菌耐药现状及治疗策略
1.1 常见细菌耐药现状
1.1.1 革兰阴性菌
1.1.1.1 肠杆菌目细菌
大肠埃希菌和肺炎克雷伯菌是临床最常见的肠杆菌目细菌,可导致血流感染、腹腔感染、呼吸系统及泌尿系统感染等严重疾病。其主要耐药机制之一是产超广谱β-内酰胺酶(ESBL)。目前,多数实验室已不再常规进行ESBL表型检测。鉴于CTX-M型是我国ESBL主要流行型别,临床上常以对头孢噻肟和头孢曲松的耐药率间接反映ESBL的流行情况。
2023年全国细菌耐药监测网(CARSS)报告显示,大肠埃希菌和肺炎克雷伯菌对三代头孢菌素的耐药率虽呈逐年下降趋势,但仍处于较高水平:大肠埃希菌的耐药率从2014年的59.7%降至2023年的48.9%,肺炎克雷伯菌则从36.9%降至27.7%(图1)[1]。
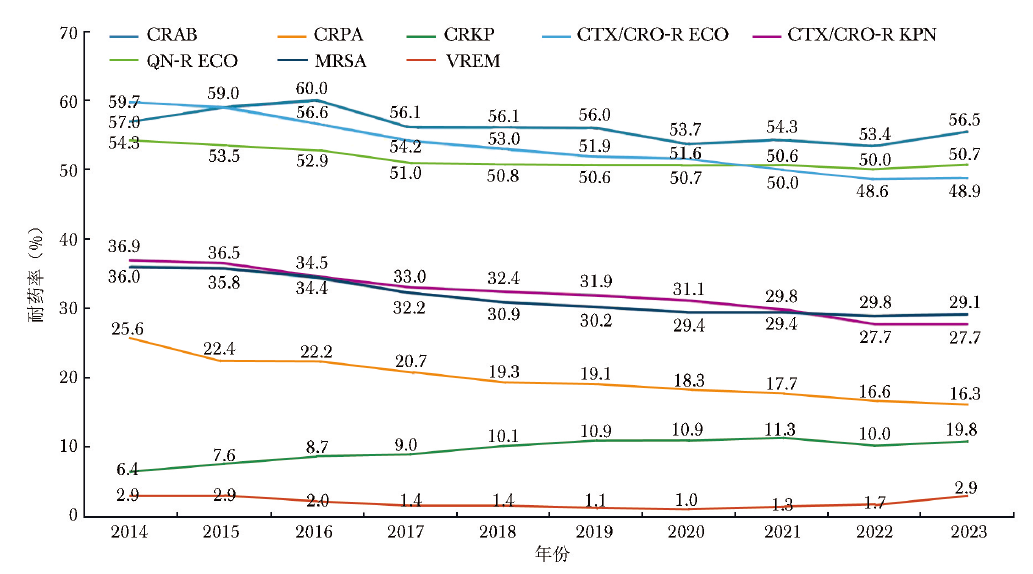
图1 重要耐药性细菌检出率分析
CRAB :耐碳青霉烯类鲍曼不动杆菌;CRPA :耐碳青霉烯类铜绿假单胞菌;CRKP:耐碳青霉烯类肺炎克雷伯菌;CTX/CRO-R ECO :耐头孢噻肟/头孢曲松大肠埃希菌;CTX/CRO-R KPN :耐头孢噻肟/头孢曲松肺炎克雷伯菌;QN-R-ECO :耐喹诺酮类大肠埃希菌;MRSA :耐甲氧西林金黄色葡萄球菌;VREM :耐万古霉素屎肠球菌
然而,全球监测数据呈现不同趋势,SENTRY耐药监测网(https://www.jmilabs.com/sentry-surveillance-program)数据显示,2023年大肠埃希菌和肺炎克雷伯菌对头孢曲松的耐药率分别升至20.7%和32.2%,较2022年(16.8%和27.5%)有明显增加[2]。
喹诺酮类药物耐药方面,2023年CARSS报告显示,大肠埃希菌对喹诺酮类药物的耐药率处于较高水平,长期维持在50%以上(图1);肺炎克雷伯菌对环丙沙星及左氧氟沙星的耐药率分别为21.4%和18.4%[1]。相比之下,全球SENTRY数据则呈现不同趋势:大肠埃希菌对喹诺酮类药物的耐药率呈缓慢下降趋势,左氧氟沙星耐药率从2019年的28%降至2023年的24.6%,环丙沙星从28.6%降至25.3%;肺炎克雷伯菌对喹诺酮类药物的耐药率相对稳定,环丙沙星耐药率为27%,左氧氟沙星基本维持在20%左右。
值得注意的是,细菌耐药率在全球不同地区之间存在显著差异。One Health Trust-ResistanceMap数据显示,喹诺酮类耐药大肠埃希菌在巴基斯坦和卡塔尔的检出率分别高达73%和72%,而在丹麦仅为10%。三代头孢菌素耐药大肠埃希菌在印度的检出率高达80%,而美国和瑞典则分别仅为15%和7%。肺炎克雷伯菌对喹诺酮类的耐药率同样呈现较大地域差异:伊朗高达77%,日本仅为4%;其他国家如沙特阿拉伯、西班牙、美国和南非的检出率分别为63%、28%、10%和47%。此外,三代头孢菌素耐药肺炎克雷伯菌在印度的检出率为80%,而在日本则低至6%[3]。
碳青霉烯耐药肺炎克雷伯菌(CRKP)在世界卫生组织(WHO)发布的2024年细菌优先病原体清单中被列为“关键优先级”病原体[4]。2023年CARSS数据显示,我国CRKP的检出率从2014年的6.4%持续上升至2023年的10.8%[1] (图1)。全球监测数据也呈现类似上升趋势,SENTRY耐药监测网数据显示,肺炎克雷伯菌对美罗培南的耐药率从2019年的8.6%上升至2023年的10.5%。
CRKP的全球分布存在显著地区差异,One Health Trust-ResistanceMap数据显示,俄罗斯的CRKP检出率高达66%,部分欧洲国家如意大利和西班牙也达到20%~30%[5],而美国仅为3%。相比之下,碳青霉烯类耐药大肠埃希菌(CRE)的整体耐药率在全球范围内普遍处于较低水平。我国大肠埃希菌对碳青霉烯类药物的耐药率约为1.7%,多数国家报告的数据也普遍低于0.3%。然而,在部分国家如印度,CRE的检出率可达29%,阿联酋则低至1%[3],显示出发展中国家与发达国家之间存在明显差异。
2023年CARSS报告显示,我国不同地区及人群中,耐药细菌的检出率存在显著差异。从地区分布来看,CRKP的检出率以上海市最高(26.2%),青海省最低(0.6%);三代头孢菌素耐药大肠埃希菌的检出率最高为西藏自治区(57.8%),最低为新疆维吾尔自治区(42.4%);三代头孢菌素耐药肺炎克雷伯菌的检出率以上海市最高(43.3%),宁夏回族自治区和青海省最低(均为9.9%)。在人群分布方面,儿童医院的三代头孢菌素耐药肺炎克雷伯菌检出率(36.4%)远高于其他三级医院(29.0%)和二级医院(21.0%)。同时,ICU中常见耐药菌的检出率普遍高于其他病区,其中CRKP在ICU的检出率达21.7%[1]。
1.1.1.2 非发酵革兰阴性菌
鲍曼不动杆菌(Acinetobacter baumannii)和铜绿假单胞菌(Pseudomonas aeruginosa)是临床常见的非发酵革兰阴性杆菌,可导致多种感染性疾病。由于其普遍存在多重耐药性,为临床抗感染治疗带来了巨大挑战。其中,碳青霉烯类耐药鲍曼不动杆菌(CRAB)是院内感染尤其是呼吸机相关性肺炎的重要病原体。CRASS报告显示,我国CRAB的检出率长期处于较高水平,由2014年的57%小幅降至2023年的55.5%(图1);而碳青霉烯类耐药铜绿假单胞菌(CRPA)的检出率则呈现持续下降趋势,由2014年的25.6%下降至2023年的16.3%(图1)。
全球监测数据也反映出类似的耐药变化。SENTRY耐药监测网数据显示,全球鲍曼不动杆菌对美罗培南、头孢他啶和环丙沙星的耐药率均显著下降,分别从2019年的63.1%、62.5%和65.4%下降至2023年的48.2%、48.8%和50.2%。铜绿假单胞菌对美罗培南和环丙沙星的耐药率也从16%和18.9%显著下降至2023年的13.8%和11.9%,其对头孢他啶的耐药率则基本保持稳定。
CRAB和CRPA的检出率在国内外均存在明显的地区差异。国内数据显示,CRAB检出率最高为河南省(74.2%),最低为青海省(28.7%);CRPA检出率最高为北京市(24.7%),最低为宁夏回族自治区(5.7%)。在全球范围内,CRAB在墨西哥的检出率高达97%,而在日本仅为1%,在部分东南亚和非洲国家低于10%;CRPA在俄罗斯的检出率为53%,美国和丹麦则分别仅为1%和4%[3],显示出显著的地区间异质性。
1.1.2 革兰阳性菌
耐甲氧西林金黄色葡萄球菌(MRSA)和万古霉素耐药肠球菌(VRE)可引起多种感染性疾病,给临床治疗带来沉重负担。在2024年WHO发布的细菌优先病原体清单中,二者均被列为“高度优先级”病原体[4]。2023年CARSS报告显示,我国MRSA的检出率近年来持续下降,从2014年的36.0%下降至2023年的29.1%。然而,万古霉素耐药屎肠球菌的耐药率则从2020年的1.0%显著攀升至2023年的2.9%(图1),该耐药现象存在明显的地区差异,例如广东省的耐药率从2022年的0.7%急剧上升至2023年的16.2%,而北京市从8.3%升至13.7%[1]。
在全球范围内,MRSA和VRE的流行趋势存在显著地域差异。SENTRY耐药监测网数据显示,万古霉素耐药屎肠球菌的全球耐药率从2019年的40.4%降至2023年的36.7%,整体呈现波动下降趋势。欧洲抗菌药物耐药监测网(EARS-Net) 2023年报告显示,自2019年以来,欧洲MRSA的检出率持续下降,从2019年的18.2%降至15.8%;同时万古霉素耐药粪肠球菌的检出率也从2022年的20.6%小幅降至19.8%[6]。
此外,One Health Trust-Resistance Map数据显示,美国MRSA检出率为45%,欧洲国家中西班牙为24%、丹麦和瑞典均低至2%;而亚洲地区中,印度MRSA检出率高达68%,韩国为49%。万古霉素耐药屎肠球菌的检出率在美国较高(68%),意大利为28%,而西班牙仅为1%[3],反映出显著的区域性流行特征。
1.2 常见细菌耐药机制
1.2.1 β-内酰胺酶介导的耐药
革兰阴性菌的耐药机制较为复杂,主要通过产生各种类型的β-内酰胺酶来水解抗生素。以肠杆菌科为例,我国ESBL菌株以CTX-M型为主,其中大肠埃希菌多为CTX-M-14型,而肺炎克雷伯菌则以CTX-M-15型为主,SHV型偶有检出。国外则以CTX-M-1、CTX-M-2、CTX-M-15最为常见[7]。
1.2.2 碳青霉烯酶介导的耐药
我国CRE的耐药机制主要由碳青霉烯酶介导,常见酶型包括KPC、NDM和OXA-48等。肺炎克雷伯菌中以KPC型酶为主,尤其是KPC-2和KPC-3型,总占比超过70%;而大肠埃希菌中,NDM型酶则占主导地位,以NDM-1和NDM-5型最为常见[8]。
成人及儿童患者CRE菌株的碳青霉烯酶基因分布存在显著差异,成人中最常见的基因型为KPC-2(检出率为70.3%),其中87%来源于肺炎克雷伯菌;成人大肠埃希菌中则以NDM-5为主(67.4%)。在儿童患者中,NDM-5(32.9%)与KPC-2(35.1%)的检出率相近,成为最主要的两种基因型。此外,儿童肺炎克雷伯菌中有13.3%携带OXA-232基因,该基因在成人中未见报道[9]。
这些差异反映出不同年龄群体CRE感染的碳青霉烯酶基因分布及流行病学特征存在显著区别。在全球范围内,美国CRE以KPC-3为主要流行型别,南亚地区以NDM型为主,中东和部分欧洲地区则出现OXA-48的局部流行。在非发酵菌中,CRPA的耐药机制主要依赖IMP型、VIM型金属β-内酰胺酶(MBL)与外排泵的协同作用,形成多重耐药表型;而CRAB在我国超过90%的菌株产OXA-23型碳青霉烯酶[10]。
1.2.3 耐药基因的水平转移与传播
在耐药基因的水平转移过程中,碳青霉烯类、黏菌素类及四环素类等多种抗菌药物的耐药基因可通过接合性质粒或可移动遗传元件在不同菌株甚至不同菌种之间迅速传播。在我国畜牧业中,黏菌素的长期过度使用促进了携带mcr基因的质粒在临床病原菌中广泛传播。此外,质粒介导的新型耐药基因簇TMexCD1-TOprJ1已在多种革兰阴性菌中被检出,该基因可主动外排多种药物,导致对包括四环素类在内的多种抗菌药物产生耐药。
1.2.4 耐药机制的地域与菌种差异
细菌耐药性在全球范围内存在显著的地域差异,其耐药机制和流行特征呈现多样化发展趋势。以MRSA为例,其耐药机制主要依赖于由mecA基因编码的低亲和力青霉素结合蛋白PBP2a,导致β-内酰胺类药物作用靶位改变。
在我国,MRSA的耐药机制以mecA基因为主,而在欧美地区除mecA外,还有mecC变异株的报道。值得注意的是,我国医院环境中MRSA的流行克隆谱系已发生明显变迁,ST59型逐渐取代ST239成为当前主要流行型别,这一演变趋势提示应持续加强耐药监测和医院感染控制,并借助基因组学技术实时追踪耐药菌的变异与传播[11]。
VRE方面,我国流行的菌株以vanA型为主(占比超过89%),而欧美地区则同时流行vanA和vanB型,在澳大利亚和北欧等地区,vanB型占比甚至超过30%。这种地域分布差异可能与农业中抗菌药物的使用政策有关。耐药机制的持续演进和地域差异使临床抗感染治疗面临日益严峻的挑战。因此,有必要进一步加强细菌耐药性监测、优化抗菌药物管理策略,并推动新型抗菌药物的研发与临床应用。
1.3 抗菌治疗策略
临床感染的经验性初始治疗至关重要。医生应根据感染类型、部位及当地耐药监测数据评估可能的病原菌,优先选择耐药率较低的抗菌药物。药物选择需结合药代动力学/药效学(PK/PD)原则,确保药物能有效到达感染部位,且治疗效果良好。在获得病原学鉴定及药敏结果后,应及时调整为针对性目标治疗,并根据药敏结果、药物组织渗透性及患者肝肾功能、免疫状态等个体因素进行优化。
1.3.1 产超广谱β-内酰胺酶肠杆菌目细菌(ESBL-E)感染
针对ESBL-E感染,抗菌药物选择需根据感染严重程度、部位及药敏结果个体化决定:社区获得性或轻中度感染可选用β-内酰胺类/酶抑制剂复合制剂、头霉素类、氧头孢烯类等对体外敏感有效的药物;重症感染则优先选择碳青霉烯类药物。需注意的是,喹诺酮类普遍耐药,因此不推荐用于经验治疗,仅药敏试验敏感时可用于泌尿系统感染;氨基糖苷类虽耐药率较低,但因单药疗效较差、耳毒性及肾毒性显著,需与其他抗菌药物联合使用;替加环素不适用于血流感染或泌尿系统感染;磷霉素则因尿浓度高,适用于敏感菌所致下尿路感染[12]。
1.3.2 CRE感染
CRE感染的治疗应基于药敏结果及当地流行病学制定个体化方案。对于产丝氨酸碳青霉烯酶(如KPC或OXA-48)的菌株,首选头孢他啶-阿维巴坦,也可选用亚胺培南-瑞来巴坦;而产金属酶菌株则推荐采用头孢他啶-阿维巴坦联合氨曲南的治疗策略[13]。多黏菌素虽然对CRE的耐药率较低,但建议与其他药物联用以增强疗效,治疗中需密切监测肾功能,肺部感染可考虑联合雾化吸入[8]。
替加环素适用于CRE引起的腹腔和肺部感染,但因血药浓度低,不推荐用于血流或中枢神经系统感染;依拉环素在体外对CRE的抗菌活性优于替加环素,且肺组织浓度更高,更适用于肺部感染。磷霉素和氨基糖苷类一般建议与其他抗菌药物联合使用。碳青霉烯类药物不推荐常规用于CRE感染治疗,仅当最低抑菌浓度(MIC)<4 mg/L时,可通过增加给药剂量、延长输注时间提高疗效,并联合其他药物治疗。
1.3.3 CRPA感染
对于CRPA感染的治疗,若对传统β-内酰胺类药物敏感,可增加剂量并延长输注时间。中重度感染推荐使用新型β-内酰胺类复方制剂(如头孢他啶-阿维巴坦、头孢洛扎-他唑巴坦、亚胺培南-西司他丁-瑞来巴坦、头孢德罗)。重症感染推荐联合治疗方案,通常包括1种β-内酰胺类药物,联合环丙沙星、多黏菌素、磷霉素、氨基糖苷类等抗菌药物[14],三药联合方案可提升疗效并延缓耐药。
1.3.4 CRAB感染
CRAB感染需结合药敏结果、感染部位、病情严重程度及患者的病理生理状态制定联合方案。常用方案以舒巴坦及其复合制剂(如头孢哌酮-舒巴坦、氨苄西林-舒巴坦)、多黏菌素、四环素衍生物(替加环素、依拉环素)为核心,联合喹诺酮类、氨基糖苷类和碳青霉烯类(当MIC<4 mg/L时,可增加剂量并延长输注时间)进行治疗,其中舒巴坦及其复合制剂用于CRAB治疗时推荐剂量加大至(6.0~9.0)g/d。
美国感染病学会(IDSA)指南推荐将舒巴坦-度洛巴坦联合碳青霉烯类作为CRAB的首选方案,次选方案包括大剂量氨苄西林-舒巴坦联合多黏菌素B、米诺环素、替加环素或头孢德罗等[15]。头孢哌酮-舒巴坦在体外对不动杆菌表现出协同抗菌活性,其敏感性优于氨苄西林-舒巴坦,是我国临床治疗CRAB感染的重要选择之一。头孢德罗对CRAB显示出较强的体外抗菌活性,但目前IDSA建议仅在其他抗菌药物治疗失败、且经体外药敏试验证实有效的情况下,联合其他敏感药物使用。使用多黏菌素类药物期间应密切监测肾功能,以防范肾毒性风险[16]。
1.3.5 MRSA感染
MRSA感染的治疗需根据感染部位、病情严重程度及抗菌药物的PK/PD特点选择抗菌药物。常用药物包括万古霉素、替考拉宁、利奈唑胺、达托霉素等。其中万古霉素适应证广泛,是多数指南推荐的一线药物,但需注意其潜在的耳毒性及肾毒性[17];替考拉宁与万古霉素的疗效相当,但因血清蛋白结合率高,需给予负荷剂量以确保达到有效血药浓度;利奈唑胺适用于肺炎及皮肤软组织感染,在2016年IDSA医院获得性肺炎及呼吸机相关肺炎指南中,其推荐等级与万古霉素相同。MRSA血流感染推荐使用万古霉素或达托霉素,治疗时应同时控制原发感染灶(如外科引流),并在使用万古霉素期间常规监测血药浓度,以优化疗效并降低毒性风险。
1.3.6 VRE感染
治疗VRE感染首选利奈唑胺或达托霉素。若菌株对氨苄西林(MIC<64 mg/L)和庆大霉素(MIC<500 mg/L)敏感,可选用大剂量氨苄西林联合氨基糖苷类药物治疗;替考拉宁适用于vanB型敏感株引起的感染。单纯尿路感染可考虑使用磷霉素、呋喃妥因或联合利奈唑胺治疗。对于多重耐药VRE感染,可联合多黏菌素与四环素衍生物类药物,必要时增加给药剂量以增强疗效[18]。
2常见真菌耐药现状及治疗策略
2.1常见真菌耐药现状
2.1.1 全球耐药现状
近年来,随着免疫抑制人群增多、侵入性医疗操作广泛开展以及广谱抗菌药物的普遍使用,侵袭性真菌病(IFD)的发病率在全球范围内均呈上升趋势。据估算,全球每年IFD发病人数约为650万例,归因死亡率高达68%[19]。常见真菌的耐药率也呈上升态势,且存在显著地区差异[20]。
在全球范围内,念珠菌属对氟康唑获得性耐药的主要菌种包括光滑念珠菌(耐药率为0~48%)[21]、近平滑念珠菌复合群(耐药率为0~33%)[22]、热带念珠菌(耐药率为0~42%)[23]和耳念珠菌[24]。多数研究显示,热带念珠菌对氟康唑的耐药率约为0~18%,但近10年来上升了3~4倍[23],值得高度关注。
耳念珠菌对临床上现有抗真菌药物普遍表现出广泛耐药性,一项纳入67项研究的荟萃分析显示,其对氟康唑的耐药率高达91%,对两性霉素B、卡泊芬净、米卡芬净和阿尼芬净的耐药率分别为12%(5%~85%)、12%(0.2%~23.6%)、0.8%和1.1%[25]。总体而言,念珠菌属对棘白菌素类药物的耐药仍较为少见[20]。而曲霉属中的烟曲霉对唑类药物的敏感率在不同研究中差异显著(9.6%~100%),目前全球已有20多个国家报告出现唑类耐药烟曲霉[26]。该菌对棘白菌素类药物普遍高度敏感,多项研究显示,即使对唑类耐药的烟曲霉仍对棘白菌素类药物保持100%敏感;此外,烟曲霉对两性霉素B也普遍敏感(敏感率为96.6%~100%)[26],但两性霉素B的耐药主要见于其他菌种(土曲霉、黄曲霉和黑曲霉)[27-28]。
2.1.2 我国耐药现状
中国医院侵袭性真菌病监测网(CHIF-NET)2015—2017年监测数据显示[29],我国念珠菌菌血症分离菌株中,白念珠菌和近平滑念珠菌复合群对唑类药物耐药率或非野生型率均<6%,其中拟平滑念珠菌对氟康唑和伏立康唑耐药率较高(分别为21.4%和10.0%);热带念珠菌对氟康唑和伏立康唑的敏感率分别仅为63.5%和49.2%,且26.5%的菌株存在唑类交叉耐药。
值得注意的是,2010—2018年热带念珠菌对氟康唑的耐药率从5.7%显著上升至31.8%[30];光滑念珠菌对氟康唑的耐药率为10.2%;而94%以上的克柔念珠菌对除氟康唑外的唑类药物仍保持敏感或为野生型。
棘白菌素类和两性霉素B对我国血流感染分离的念珠菌敏感性较高,非野生型率或耐药率分别低于4%和2%。
在曲霉耐药性方面,一项多中心研究显示,2017—2020年我国75株烟曲霉对艾沙康唑和伏立康唑的野生型率分别为92%和93.3%[31]。另一研究也表明,在我国390株烟曲霉中,对三唑类药物MIC>2 mg/L的菌株仅占3.3%[32],这些结果均提示目前我国临床分离的烟曲霉对三唑类药物仍保持较高敏感性。
2.2常见真菌耐药机制
2.2.1 唑类药物
唑类药物的耐药机制复杂多样,主要涉及外排泵过度表达、药物靶位改变或数量增多、Erg11p介导的固醇生物合成途径改变、代偿性应激反应及生物膜形成[33]。在念珠菌中,外排泵系统主要由ATP结合盒(ABC)转运蛋白(如Cdr1p和Cdr2p)和主要协同转运蛋白超家族(MFS)转运蛋白(如Mdr1p)介导,这些蛋白的过度表达与临床唑类耐药密切相关。类似机制也存在于曲霉中,例如烟曲霉和黄曲霉中的ABC转运蛋白Cdr1B已被证实与唑类耐药相关[28]。
Erg11蛋白(Erg11p)作为唑类药物的作用靶点,其编码基因ERG11的突变可引起蛋白构象改变,从而降低药物与靶点的结合亲和力;而该基因的过度表达则导致Erg11p浓度升高,进而持续激活麦角甾醇生物合成通路,降低细胞对唑类药物的敏感性。这一上调过程通常由转录调控因子Upc2p发生功能获得性(GOF)突变所驱动。
烟曲霉对唑类药物的耐药主要源于两方面:一是在慢性曲霉感染中长期接受唑类药物治疗导致真菌反复药物暴露;二是环境中直接吸入耐药孢子。农业中广泛使用唑类杀菌剂也与烟曲霉耐药密切相关[34]。唑类杀菌剂暴露可诱导烟曲霉羊毛甾醇14α-脱甲基酶编码基因CYP51A发生突变,从而影响麦角甾醇合成,最常见的突变位点为TR34/L98H和TR46/Y121F/T289A。除CYP51A突变外,长期唑类药物治疗还可引起羟甲基戊二酰辅酶A还原酶编码基因HMG1发生突变,该酶是麦角固醇合成途径中的关键限速酶[28]。
2.2.2 棘白菌素类药物
棘白菌素类药物的耐药性主要与FKS基因热点区突变相关,这些突变会导致β-(1,3)-D-葡聚糖合成酶对药物的亲和力下降。在不同种类的念珠菌中,FKS1突变常见于白念珠菌、热带念珠菌、克柔念珠菌和光滑念珠菌,而FKS2突变则仅见于光滑念珠菌[34]。除FKS基因本身突变外,其上游转录调控因子的突变也可能影响棘白菌素的耐药性[35]。在曲霉属中,烟曲霉的FSK1基因若发生S678P或E671Q突变,则与棘白菌素耐药相关;而在黄曲霉中,P型ATP酶和泛醌生物合成甲基转移酶COQ5可能参与卡泊芬净耐药机制的形成[28]。
2.2.3 5-氟胞嘧啶(5-FC)
5-FC的耐药性通常与三种关键酶——胞嘧啶脱氨酶(FCY1)、胞嘧啶通透酶(FCY2)或尿苷磷酸核糖转移酶(FUR1)中任一编码基因的突变或缺失有关。已在5-FC耐药的念珠菌临床分离株中鉴定出FUR1、FCY1和FCY2基因的非同义突变,这些遗传变异可导致相应功能蛋白结构或表达异常,从而降低药物敏感性[35]。
2.2.4 两性霉素B
两性霉素B的耐药机制主要与真菌细胞膜中麦角固醇数量减少或结构改变有关,这些变化会显著降低药物与靶点脂质的结合能力。此外,其他机制如氧化应激反应增强、生物膜形成以及细胞壁成分(如几丁质和葡聚糖)的改变也与其耐药性相关[35]。
2.3抗菌治疗策略
2.3.1 念珠菌血症
国内外指南均推荐将棘白菌素类药物作为念珠菌血症的一线治疗选择。对于确诊或疑似抗真菌药物耐药、治疗失败或不耐受棘白菌素类药物的患者,建议首选两性霉素B脂质体(LAmB)进行治疗[36]。在明确菌种、获得药敏结果并综合考虑当地流行病学特征及患者临床状况后,可在适宜情况下尽快转换为唑类药物进行口服序贯治疗。若感染由光滑念珠菌、耳念珠菌、唑类耐药的热带念珠菌或近平滑念珠菌引起,则应考虑采用二线治疗方案。
2.3.2 眼部念珠菌病
当病原菌对其他抗真菌药物产生耐药性时,系统性LAmB可作为眼部念珠菌病的替代治疗方案[36]。
2.3.3 隐球菌病
LAmB联合氟胞嘧啶是治疗隐球菌性脑膜炎和播散性隐球菌病的首选诱导治疗方案。若存在氟康唑耐药,建议延长诱导治疗周期(如延长至4周),并采用两性霉素B或大剂量LAmB联合氟胞嘧啶;两性霉素B或LAmB也可用于巩固或维持治疗阶段。根据药敏结果,对于不显示泛唑类耐药的菌株,可选用伏立康唑、泊沙康唑、艾沙康唑或伊曲康唑进行治疗。在无法获得两性霉素B或LAmB的情况下,可考虑采用氟胞嘧啶联合高剂量氟康唑作为替代方案[37]。
2.3.4 曲霉病
①血液病患者合并侵袭性曲霉病(IA)时,推荐将伏立康唑或艾沙康唑作为一线治疗药物。若疑似三唑类耐药曲霉感染,可选择LAmB作为初始或挽救治疗的替代方案。当其他唑类药物及LAmB均无法使用时,可考虑使用泊沙康唑或棘白菌素类药物进行挽救治疗。
②实体器官移植受者发生IA时,伏立康唑仍为一线治疗选择;如考虑耐药或不适用,建议换用LAmB作为替代方案。
③ICU患者罹患侵袭性肺曲霉病时,推荐伏立康唑作为一线治疗,LAmB可作为替代药物。棘白菌素类药物建议用于挽救治疗,并优先考虑联合用药策略。
④慢性肺曲霉病的一线治疗推荐口服伏立康唑或伊曲康唑。若出现耐药或治疗失败,可改用棘白菌素类或两性霉素B静脉制剂作为替代方案。
⑤中枢神经系统曲霉病推荐以伏立康唑作为标准治疗方案。如疗效欠佳或患者无法耐受,建议使用两性霉素B进行替代治疗[38]。
2.3.5 毛霉病挽救治疗
当首选抗真菌药物疗效不佳或出现无法耐受的不良反应时,应考虑更换药物。具体替代策略如下:若初始治疗采用两性霉素B脂质制剂或两性霉素B脱氧胆酸盐(AmBD),因疗效不足或发生肾功能损害等严重/不可逆不良反应时,可改用艾沙康唑静脉制剂、泊沙康唑静脉制剂、肠溶片或口服混悬液;若初始治疗采用艾沙康唑或泊沙康唑,因疗效不佳或出现严重/不可逆不良反应时,可换用两性霉素B脂质制剂或AmBD;若初始治疗采用AmBD并出现严重/不可逆不良反应时,可改用LAmB、艾沙康唑或泊沙康唑[39]。
3小结
本文系统阐述了当前微生物耐药的全球现状,重点围绕常见耐药细菌与真菌的流行病学特征、主要耐药机制及相应治疗策略展开探讨,阐明了常见耐药细菌和真菌的耐药机制。基于上述发现,本研究提出多维度协同应对策略,强调应通过合理使用抗菌药物、加强耐药性监测体系建设、优化个体化治疗方案以及制订有效的感染防控措施,共同应对日益严峻的微生物耐药挑战。
(本文编辑:李慧文)
来源: 协和医学杂志


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 协和医学杂志
协和医学杂志 
