- 癌症免疫治疗的发展正在快速前进,但也面临关键难题:如何让免疫系统准确识别、定位并清除肿瘤?中国药科大学高向东/尹骏课题组提出了一种新思路——让肿瘤在体内“自己变成疫苗”,激发强大的免疫反应。这项策略名为 PPTV(金属蛋白模块化体内疫苗),在小鼠乳腺癌模型中表现出显著的抗癌能力。2025 年 11 月 19 日,该研究以“A modular metalloprotein in situ vaccine for cancer immunotherapy in mouse models of breast cancer”为标题,发表于 Science 子刊 Science Translational Medicine 上。
为什么要让肿瘤“变成疫苗”?
肿瘤细胞通常通过伪装来逃避免疫系统的攻击,因此许多治疗方法无法保持持久效果。研究人员希望找到一种方式,将肿瘤细胞“暴露”出来,让免疫系统主动识别并清除它们。这就需要诱导一种特殊的细胞死亡方式——免疫原性细胞死亡(ICD)。ICD 会让肿瘤细胞释放危险信号和抗原,像“信号灯”一样吸引免疫细胞。这样,肿瘤自身就变成了“疫苗”,能够教会免疫系统识别癌细胞。
PPTV:一个“模块化金属蛋白”构建的体内疫苗
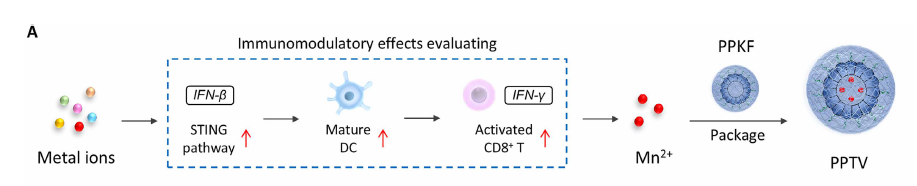
图1. PPTV疫苗构建方法
研究团队设计的 PPTV 是一种精巧的“模块化”纳米结构,由两个核心部分组成:
① 能摧毁肿瘤细胞线粒体的肽(KLA)
专门破坏肿瘤细胞的能量工厂(线粒体)
引发大量活性氧(ROS)
强力诱导免疫原性细胞死亡(ICD)
② 铁蛋白作为纳米载体,内部装载 Mn²⁺ 金属离子
Mn²⁺ 能够:
强烈激活先天免疫重要通路 cGAS-STING
促进干扰素与免疫因子的释放
提高树突状细胞和 T 细胞的激活能力
这样,PPTV 就是一种“既能杀肿瘤,又能激免疫”的双功能纳米系统。
让药物只在肿瘤里被激活:精准的“剪刀机制”
一个重要难题是如何确保药物只在肿瘤中发挥作用、减少副作用。
为此,研究团队设计了一个“开关结构”:
在金属蛋白外层加入一段保护性蛋白“PSTAG”,相当于“安全锁”
只有肿瘤环境中的特定蛋白酶 MMP14 才能剪开它
因此 PPTV 只在肿瘤中被解锁与激活
这种机制极大提高了安全性,避免了对正常组织的损伤。
PPTV 在动物实验中展现的四大能力
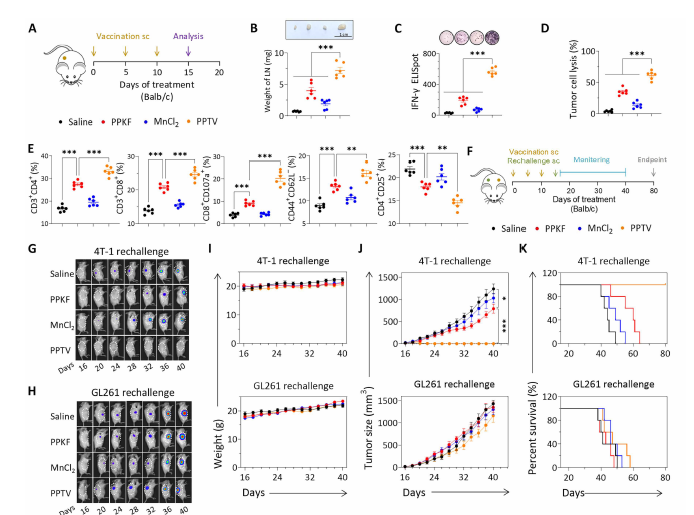
图2. 小鼠模型肿瘤抑制实验
1. 强效激活免疫系统
增加树突状细胞成熟
促进 T 细胞(特别是 CD8⁺ 杀伤 T 细胞)进入肿瘤
提高干扰素、IL-2 等关键免疫因子水平
2. 有效缩小肿瘤体积
在乳腺癌小鼠模型中,PPTV 显著抑制 tumor growth,并提高生存率。
3. 防止肿瘤复发
当小鼠被重新注入相同肿瘤细胞后,接种 PPTV 的小鼠几乎不会再次长出肿瘤。这表明 PPTV 建立了持久“免疫记忆”。
4. 抑制远处转移
在肺转移模型中:
几乎看不到肿瘤转移灶
肺脏重量与病理切片均显示转移显著减少
与免疫检查点治疗联用:效果更强
研究还发现,PPTV 与 PD-L1 抑制剂(免疫检查点治疗)联合使用时,小鼠体内的肿瘤全部被清除。这是现代癌症免疫疗法最受关注的 synergistic 方向。
为什么这项研究值得关注?
✔ 让肿瘤“自我生成疫苗”是癌症治疗的前沿策略
不依赖外源抗原,而是利用肿瘤自身作为个体化疫苗。
✔ 有望解决肿瘤异质性与逃逸问题
因为疫苗来源于患者自身肿瘤抗原,更有可能覆盖多种突变位点。
✔ 模块化设计便于拓展
铁蛋白载体 可更换的肽序列 可更换的金属离子
意味着未来可能用于其他肿瘤类型或免疫疾病。
✔ 安全性机制完善
肿瘤特异性激活
金属离子高效封装减少泄漏
动物实验未见明显毒性
未来展望:迈向个体化免疫治疗
虽然 PPTV 目前仍处于动物研究阶段,但其创新性非常突出:
可根据患者肿瘤特点替换 ICD 肽序列
可根据免疫需求调整金属离子(如 Mg²⁺、Zn²⁺)
有潜力作为 通用平台 推进个体化肿瘤疫苗的开发
如果未来能验证其在人类中的安全性与疗效,将有望成为免疫治疗的新方向。
来源: 云兮疫苗科普


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 云兮疫苗科普
云兮疫苗科普 
