异种移植的新希望与未知挑战

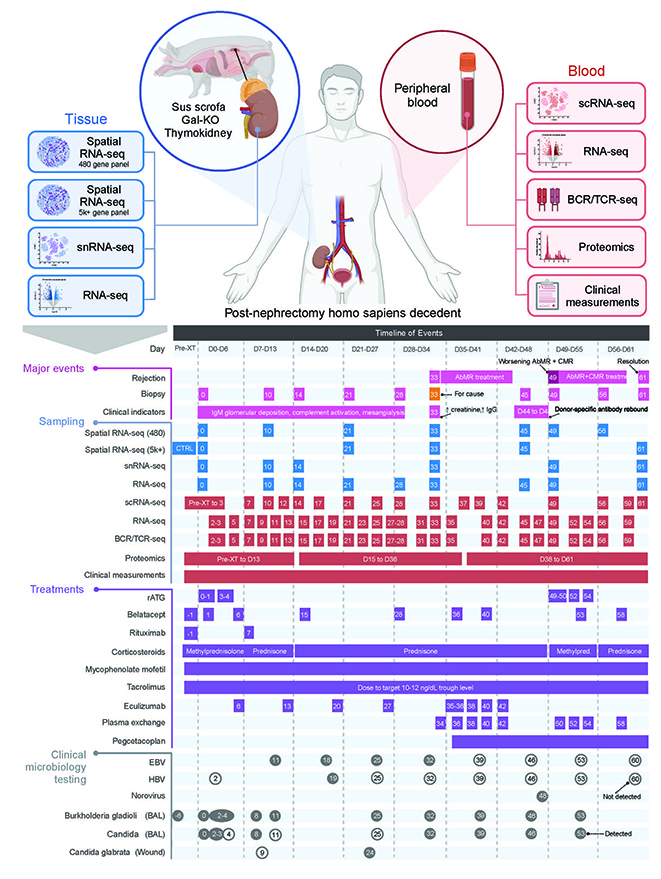
面对全球性的器官短缺危机,基因编辑猪器官被视为挽救生命的希望之光。然而,即使经过基因编辑,跨物种移植后强烈的免疫排斥反应仍是导致移植失败的主要障碍。以往,我们对于人体如何具体响应猪器官的认知存在大量空白。近日,一项发表于顶级期刊《Nature》的重磅研究,首次通过多组学分析技术,详细、动态地描绘了猪肾脏移植到一位脑死亡受体体内61天内的完整免疫过程,勾勒出一张详尽的“免疫反应路线图”。
异种移植免疫排斥三步曲
研究团队通过分析血液和移植肾的数十万份数据,发现免疫排斥并非单一事件,而是一个有序、多阶段的过程:
第一阶段:B细胞与抗体介导的排斥(术后10-28天)
血液中浆母细胞、NK细胞和树突状细胞数量显著增加,同时观察到IgG和IgA类型的B细胞克隆大规模扩增,这直接导致了术后第33天经活检确认的抗体介导的排斥反应。
第二阶段:T细胞加入战场(术后21-49天)
在抗体排斥的基础上,人体T细胞从第21天开始增加,并在第33至49天于血液和移植肾中达到峰值。T细胞受体变得多样化,并出现了一个特定的优势克隆类型(TRBV2/J1)。活检在第49天证实了抗体和T细胞介导的混合性排斥。
第三阶段:炎症“风暴”与组织损伤
在第33天,移植肾内最主要的人类免疫细胞是CXCL9+巨噬细胞,它们驱动了强烈的 IFN-γ炎症反应。研究还首次观察到猪本身的巨噬细胞与浸润进来的人类免疫细胞之间存在相互作用的迹象。早在第21至33天,肾脏组织就出现了促纤维化的肾小管和间质损伤,标志着移植肾已开始受损。
治疗启示与未来方向
蛋白质组学分析证实,人和猪的补体系统均在排斥过程中被激活,而在使用补体抑制剂治疗后,人体补体活性显著下降,这为临床干预提供了明确的靶点与有效的疗效验证。此外,该研究还精准识别出诸如特定T细胞克隆、CXCL9+巨噬细胞等关键免疫细胞及相关分子通路,为未来开发更精准的免疫抑制方案或联合疗法指明了方向。尽管实验是在脑死亡受体中完成,其发现不能直接等同于活体移植,但它为推进异种移植走向临床提供了不可或缺的分子基础与理论依据,是迈向解决器官短缺难题的关键一步。将来有希望利用更先进的组学技术,来评估异种猪肾移植后的人体免疫反应图谱变化,比如Olink蛋白组或抗体组检测技术,可更高通量、更灵敏的发现移植后免疫应答信号。
来源: 奥根诊断官网


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 移路相伴
移路相伴 