肠道菌群移植(Fecal Microbiota Transplantation,FMT)并不是一个新概念。自上世纪八十年代首次在艰难梭菌感染患者中尝试以来,它已经从临床“救急”逐渐走向科学化、规范化的微生态疗法。最近发表于 Clinical Microbiology Reviews 的综述《Fecal microbiota transplantation: current challenges and future landscapes》总结了 FMT 的发展现状、作用机制和未来方向,让我们得以系统地了解这一“换生态”的医学手段。
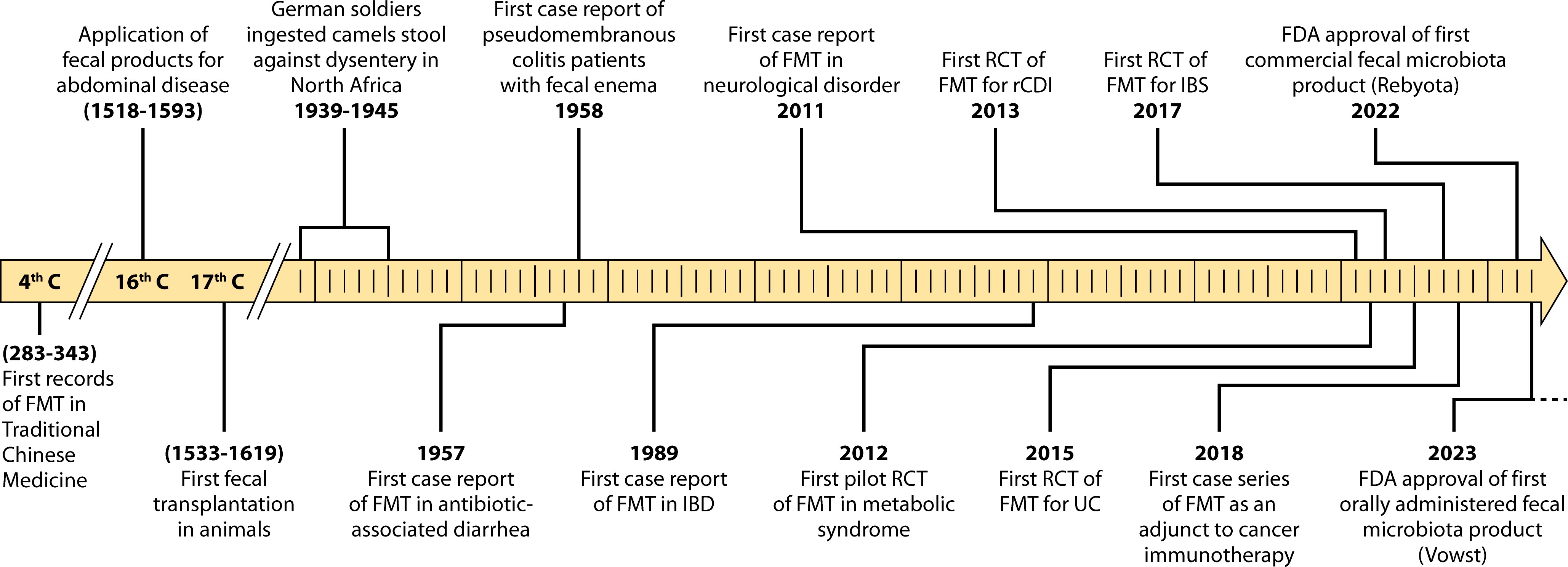
图1|FMT 在临床实践与科研中的演进历程
图中展示了 FMT 从个案救治、病例系列研究,到随机对照试验与标准化制剂开发的时间线。技术逐步规范化,也带来了伦理与监管体系的建立。
起初,FMT 被形象地称为“换粪”,但如今的研究重点早已不止于此。它更像是一场肠道生态系统的重建工程:通过健康供者的微生物群落,恢复受体肠道被抗生素、感染或代谢紊乱破坏后的生态平衡。
在所有已研究的疾病中,复发性艰难梭菌感染(rCDI)是唯一被确立的临床适应证。多项随机对照试验和系统综述表明,FMT 能显著降低感染复发率,总体有效率高达 80%–90%。它的机制在于恢复肠道“定植抗性”,即通过供者菌群的多样性与代谢能力,抑制艰难梭菌再次生长。正因如此,国际指南已将 FMT 明确列为 rCDI 的标准治疗选项。
为了理解这种作用,我们需要先看看艰难梭菌是如何致病的。
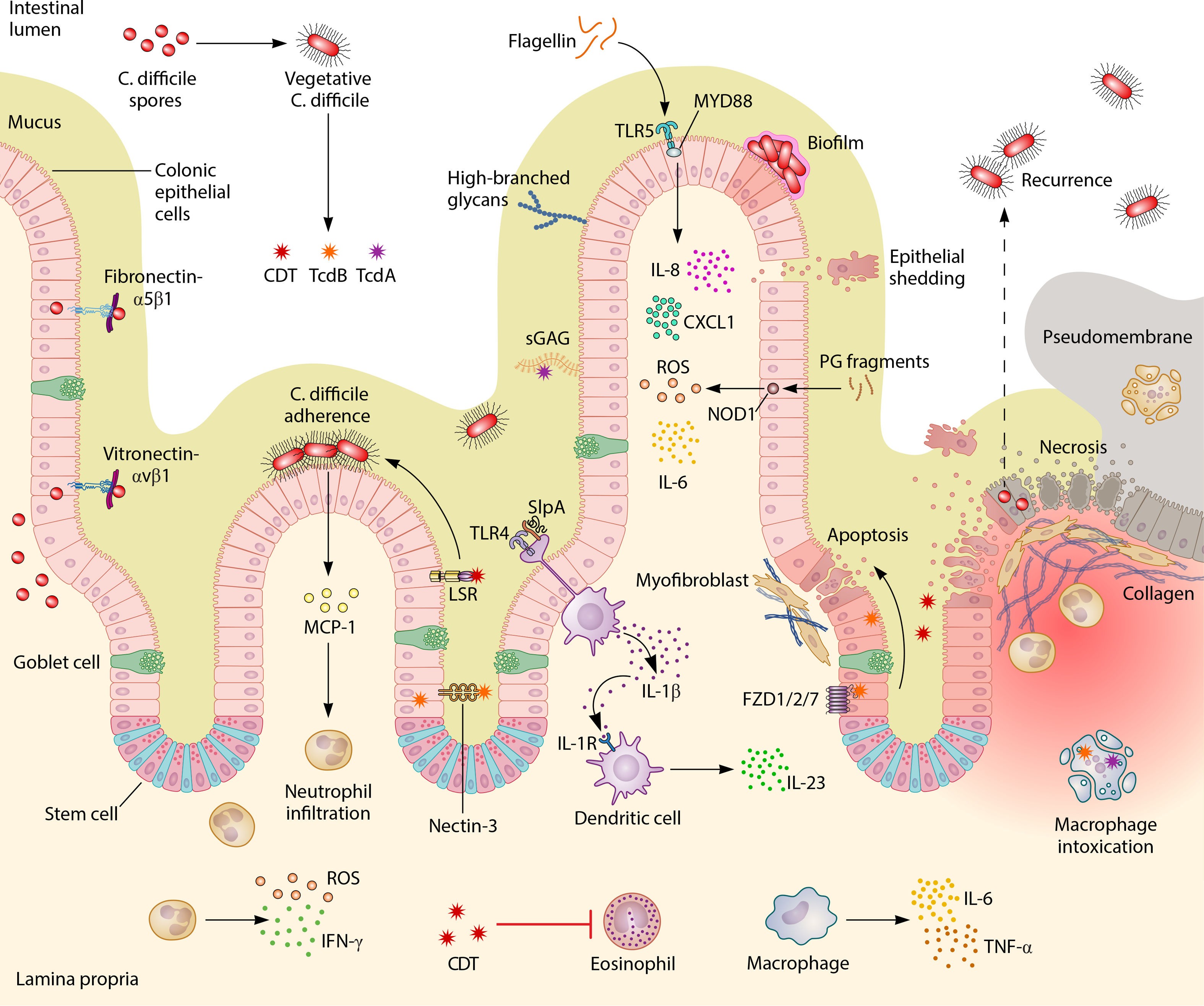
图2|艰难梭菌感染的主要致病机制
TcdA 通过糖链和硫酸糖胺与宿主上皮结合,TcdB 的受体包括糖链、nectin 3、CSPG4 和 FZD1/2/7。CDT 毒素通过 LSR 结合后被蛋白水解,其活性亚基 CDTa 破坏肌动蛋白骨架,促进黏附。C. difficile 的细胞壁肽聚糖可通过 NOD1 激活中性粒细胞趋化;表面层蛋白和鞭毛分别激活 TLR4 和 TLR5 信号通路,引发炎症。
艰难梭菌的毒素作用、免疫激活和上皮屏障破坏共同导致腹泻与肠炎。当抗生素清除了原有菌群,病原体便能趁虚而入。FMT 的意义在于恢复“生态防线”——供者菌群重新占据生态位,恢复短链脂肪酸等代谢产物,增强上皮修复和免疫稳态。
尽管 rCDI 是 FMT 的“主战场”,它的应用边界正不断拓展。溃疡性结肠炎、代谢综合征、肠易激综合征、肿瘤免疫治疗反应调节、慢性肝病、移植物抗宿主病、孤独症谱系障碍等,都成为研究热点。综述指出,这些探索大多仍处于早期阶段,样本量有限、疗效差异大,但从趋势上看,FMT 已从单一感染疾病走向系统性疾病的辅助干预。
FMT 的成功不仅依赖菌群,更取决于生态系统的多维交互。综述将其作用机制归纳为四个层面:
首先是供者菌株的功能性定植。不同个体的肠道生态位竞争力差异显著,所谓“好定植者”往往具备更强的代谢独立性和环境适应力。在抗生素预处理的 rCDI 中,供者菌群容易建立,而在炎症性肠病等环境中,定植则更难维持。
其次是病毒组和噬菌体的调节作用。FMT 不仅重建细菌层面,受体中的噬菌体群落也会向供者模式转变,Caudovirales 等病毒的丰度与多样性变化被认为可能与疗效相关。
第三是代谢产物恢复。短链脂肪酸(SCFAs)、次级胆汁酸及色氨酸代谢物的增加,与上皮修复、免疫调节和能量代谢改善密切相关。
最后是免疫通路的再平衡。FMT 通过促进 Treg 细胞上调、降低促炎因子表达,从系统层面缓解炎症。
安全性与标准化始终是 FMT 的瓶颈。供者筛查必须严格执行病原体排查与代谢性疾病排除;制备与储存流程则需在无菌、低温、可追溯的体系下完成。综述特别指出,未来的发展方向是“下一代 FMT 制剂”:即通过定义菌群集合或合成生态群落,替代整粪样移植。这不仅可提升安全与可控性,也便于药品化监管。
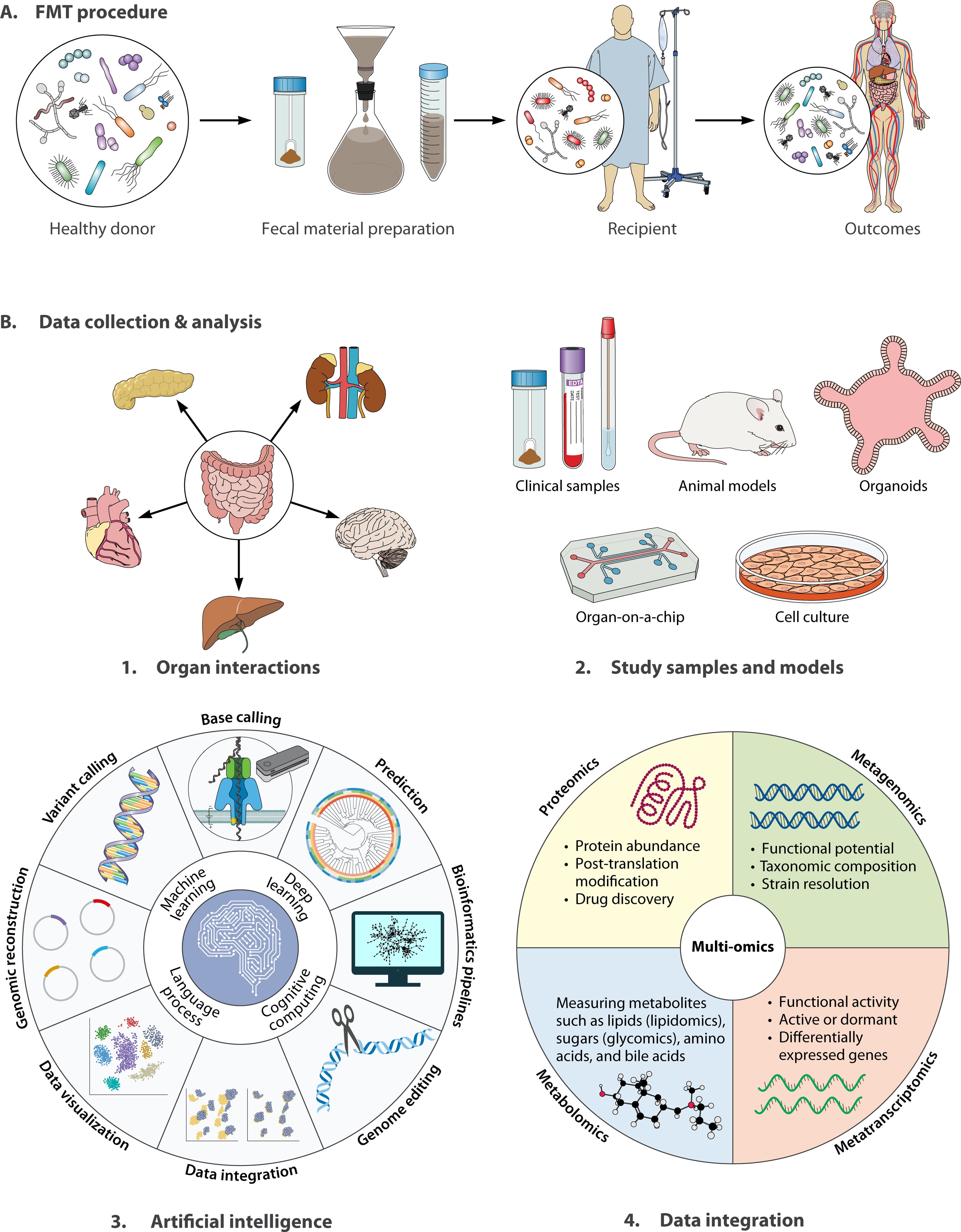
图3|微生物群治疗的未来图景
研究者正在从传统 FMT 迈向基于合成群落、定义菌群与代谢产物的精准微生态药物。
从监管角度看,美国 FDA 已批准首个活体微生物制剂 RBX2660,欧洲与中国也在建立相应伦理与质量体系。作者认为,FMT 的意义不仅在于治疗,更在于帮助我们重新理解人与微生物的共生逻辑:我们或许不是在“换粪”,而是在修复一个被打断的共生关系。
参考文献
Ao Y, Chen J, Hu S, et al. Fecal microbiota transplantation: current challenges and future landscapes. Clinical Microbiology Reviews. 2025.Dio:10.1128/cmr.00060-22
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
