二甲双胍被誉为“控糖界的常青树”,但它的经典药理解释——抑制肝糖输出、增强胰岛素敏感性——并不能完全说明它的所有临床效果。2018 年发表在 Nature Medicine 的研究《Gut microbiota and intestinal FXR mediate the clinical benefits of metformin》揭示了一个令人惊讶的事实:二甲双胍的关键作用靶点,也许并不在肝脏,而在肠道微生物群。
研究团队通过对 45 位 2 型糖尿病患者的临床随访和多组学分析发现,口服二甲双胍可在短期内显著改变肠道菌群结构。尤其是 减少 Bacteroides fragilis 的丰度,并抑制其胆汁盐水解酶(BSH)活性。这一变化打破了胆汁酸代谢的平衡,使得一种名为 GUDCA(glycoursodeoxycholic acid) 的胆汁酸显著升高。GUDCA 被证明能抑制肠道核受体 FXR(farnesoid X receptor),进而改善葡萄糖代谢。换句话说,二甲双胍通过“药—菌—胆汁酸—FXR—宿主代谢”这一链路实现了控糖效果。
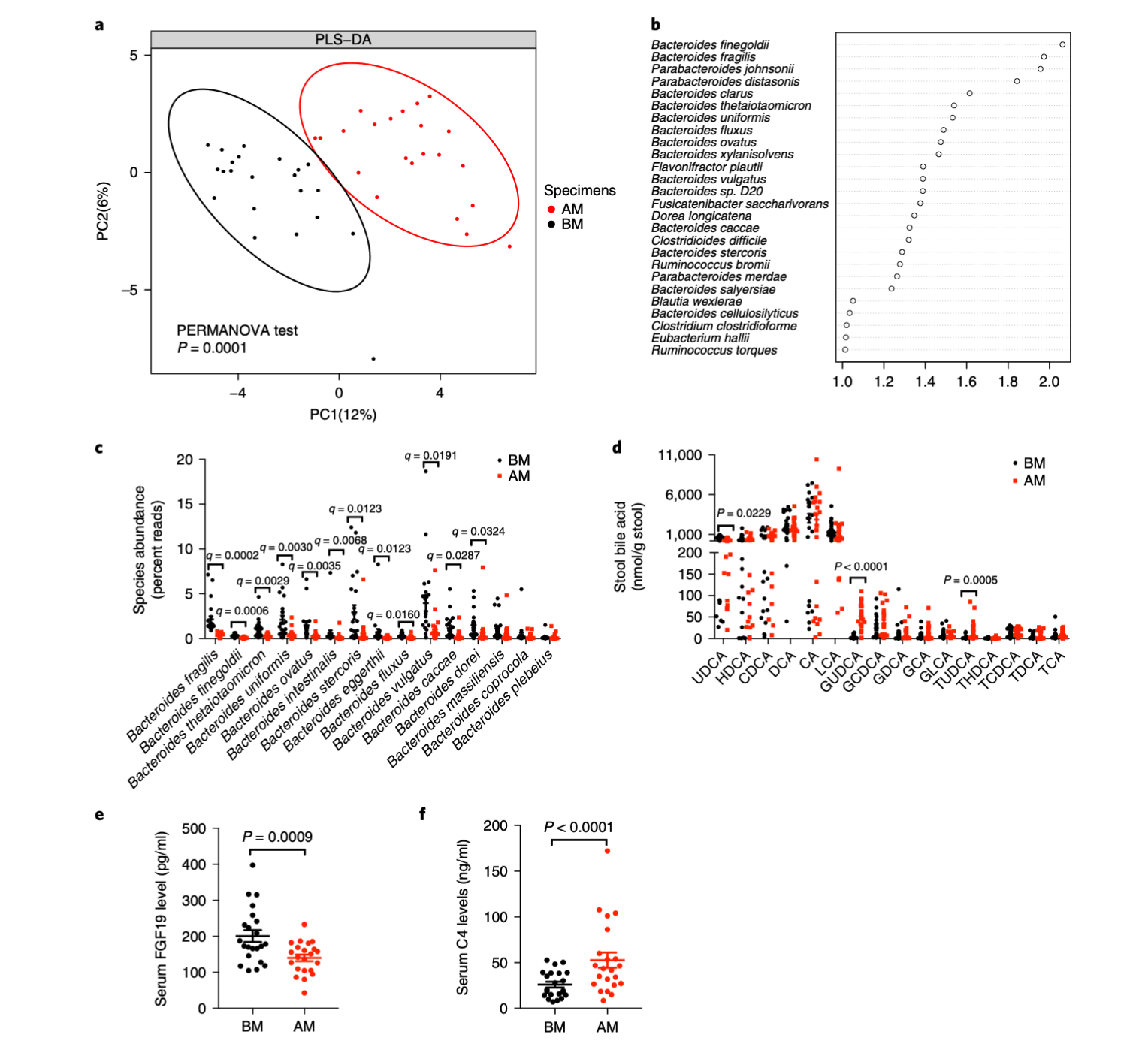
图1|二甲双胍调节糖尿病患者肠道菌群与胆汁酸代谢
(口服二甲双胍改变 2 型糖尿病患者的肠道菌群组成与胆汁酸谱。)
传统观点认为,药物进入肠道后只是被吸收或排出,但这项研究表明,肠道微生物既是代谢器官,也是药理靶点。 二甲双胍的“副产物”作用——改变肠道生态——反而成为其疗效的关键。研究人员发现,随着 B. fragilis 减少,患者的血糖和胰岛素敏感性显著改善,而这种效果与 FXR 信号下调高度一致。
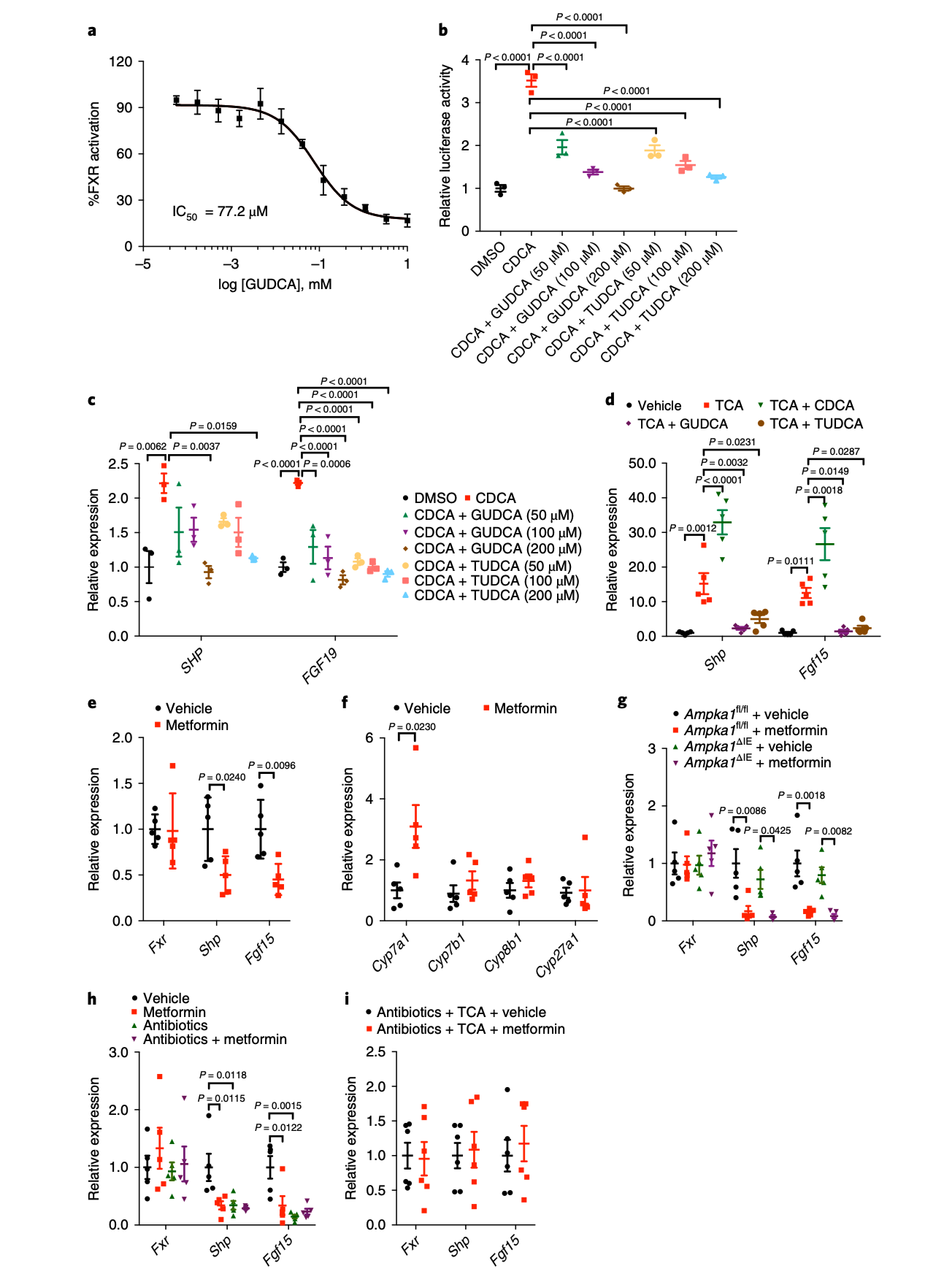
图2|GUDCA 与 TUDCA 被鉴定为 FXR 拮抗剂
进一步的细胞与动物实验验证了这一机制:GUDCA 能直接与 FXR 结合,阻断其激活信号,从而减弱胆汁酸‑FGF15 轴对肝脏糖异生的抑制,最终提升胰岛素敏感性。与此同时,另一种胆汁酸 TUDCA 也被发现具有相似的 FXR 拮抗作用。二者在肠道形成互补调节,使得二甲双胍的代谢效应得以放大。
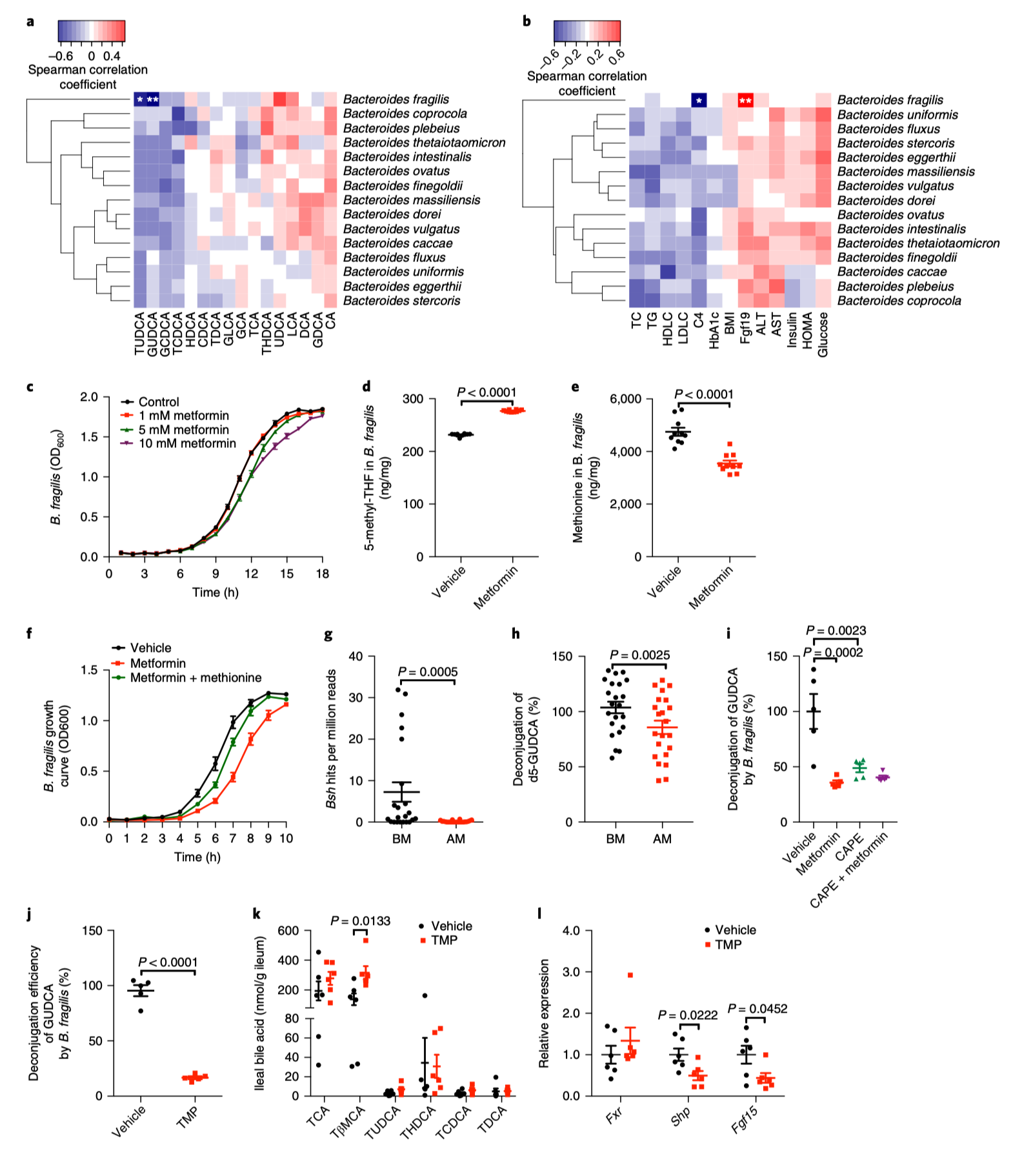
图3|二甲双胍下调 B. fragilis 丰度与胆汁酸谱变化呈负相关
为了验证因果关系,研究者进一步在无菌小鼠中移植人源菌群:当重新补充 B. fragilis 后,二甲双胍改善葡萄糖代谢的效果显著减弱;而补充 GUDCA 则能部分恢复这一疗效。这说明,药物效应取决于菌群背景——肠道生态的差异,决定了药理反应的个体差异。
更深层的启示在于:二甲双胍不仅改变菌群,还“再定义”了胆汁酸这一传统代谢分子的功能,使其成为药理信号的一部分。FXR 作为胆汁酸受体,不再只是肝脏的代谢调节因子,而是连接微生物与宿主代谢的关键枢纽。
这项研究让我们重新思考“药物”的定义。二甲双胍的疗效并非单纯依赖分子结构,而是与体内共生系统协作完成。药理学与微生态学在此交汇,传统的药物靶点概念正被重新书写。
参考文献
Sun L., Xie C., Wang G., Wu Y., Wu Q., Wang X., Liu J., Deng Y., Xia J., Chen B., Zhang S., Yun C., Lian G., Zhang X., Zhang H., Bisson W.H., Shi J., Gao X., Ge P., Liu C., Krausz K.W., Nichols R.G., Cai J., Rimal B., Patterson A.D., Wang X., Gonzalez F.J., Jiang C. Gut microbiota and intestinal FXR mediate the clinical benefits of metformin. Nature Medicine. 2018; 24: 1919–1929. doi:10.1038/s41591‑018‑0222‑4
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
