现代医学的每一次进步,都伴随着对“药物”的再认识。我们知道剂量、半衰期、代谢酶,却往往忽略了另一个参与者——肠道微生物群。最新发表于 Nature Reviews Gastroenterology & Hepatology 的综述《Interaction between drugs and the gut microbiome》指出:药物与肠道菌之间的关系,是一场双向、复杂且影响深远的化学与生态博弈。
药物不只是被吸收的分子,也是一种环境压力。上万亿肠道细菌暴露在药物中,会发生选择、适应乃至进化。研究者发现,超过四分之一的非抗生素药物都能显著改变菌群的组成和功能。这种改变不仅影响药物的疗效,还可能间接作用于代谢、免疫甚至行为。

图1|药物与肠道微生物之间的多种相互作用示意图
(常用非抗生素药物与肠道微生物之间不同类型相互作用的概览图。SCFA 为短链脂肪酸。)
研究团队总结了肠道菌与药物的三种主要互动路径:其一,药物影响菌群——部分药物具有抗菌样作用,会抑制特定细菌的生长,从而改变菌群结构;其二,菌群影响药物——细菌通过代谢酶修饰药物分子,使其活性增强或减弱;其三,菌群代谢产物反过来影响宿主药物反应。这三条路径交织在一起,使每一次药物治疗都变成一次生态事件。
例如,质子泵抑制剂(PPI)被发现可增加肠道中肠球菌与葡萄球菌的比例,长期使用会提升感染风险;而二甲双胍(Metformin)则通过调节产丁酸菌和黏蛋白降解菌群,间接改善胰岛素敏感性。药物改变菌群,菌群也在重写药物的生理脚本。
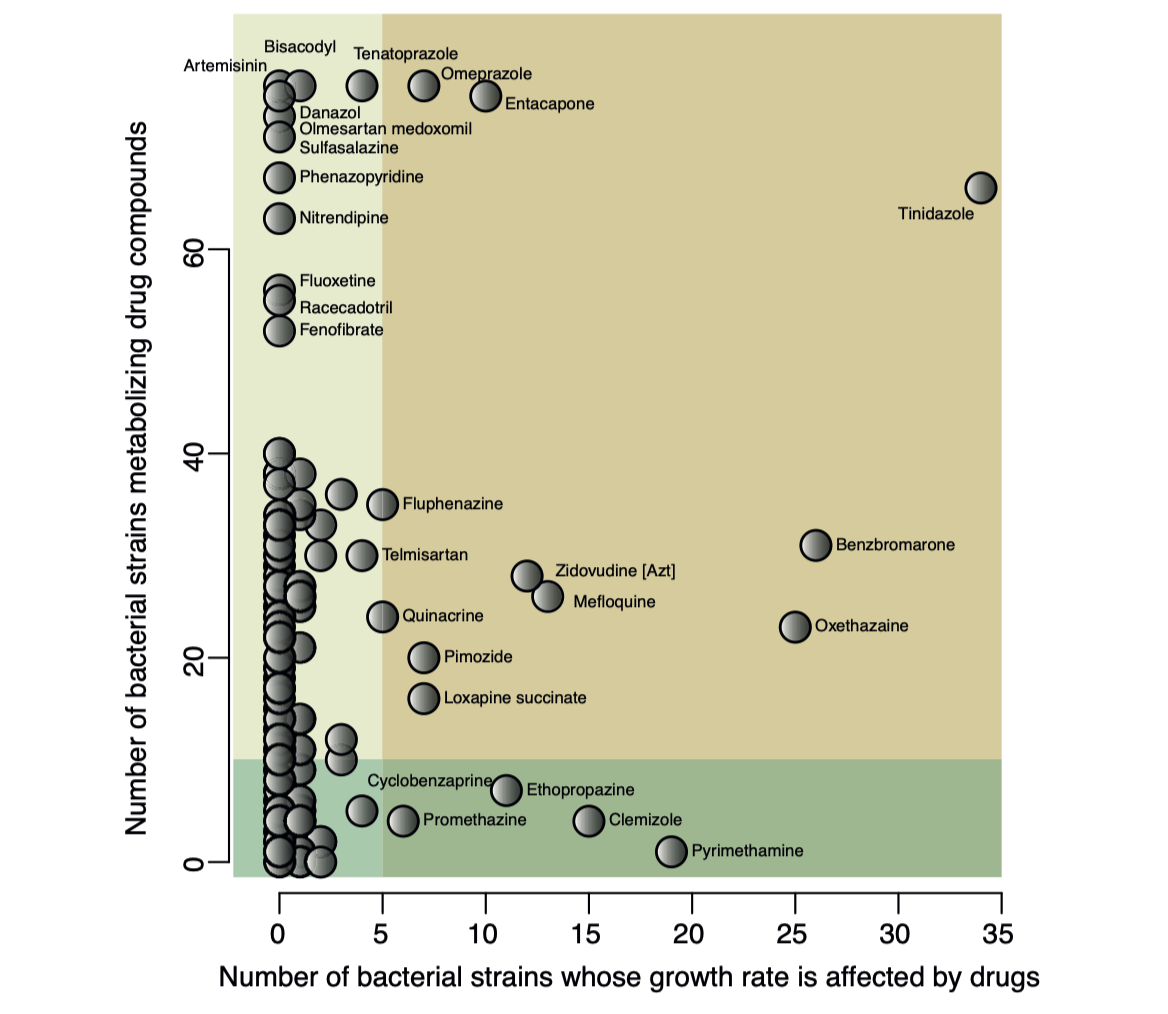
图2|常用药物对细菌生长与代谢的双向影响
(常用药物的双向效应。横轴为药物对 40 株细菌生长速率的影响数目,纵轴为能代谢该药物的 76 株细菌数量。数据来源于 Maier L 等(Nature 2018)和 Zimmermann 等(Nature 2019)。)
肠道菌不仅能“解毒”药物,也能“改药”。某些细菌表达还原酶、脱羧酶或硫转移酶,可改变药物结构,使原本无效的前药转化为活性代谢物;但同样的机制,也可能产生毒性。一个著名例子是抗肿瘤药物伊立替康(irinotecan):它在肝脏被代谢为无毒形式,经肠道细菌的β‑葡萄糖醛酸苷酶重新激活,从而导致严重腹泻。同样的药,不同的菌群,可能决定疗效与副作用的天平。
而在免疫治疗领域,肠道微生物的影响更为直接。研究表明,肠道菌群多样性高、富含 Akkermansia muciniphila、Bifidobacterium longum 或 Faecalibacterium prausnitzii 的患者,对 PD‑1 或 CTLA‑4 抑制剂反应更好。反之,抗生素暴露或菌群紊乱则显著降低免疫治疗响应率。
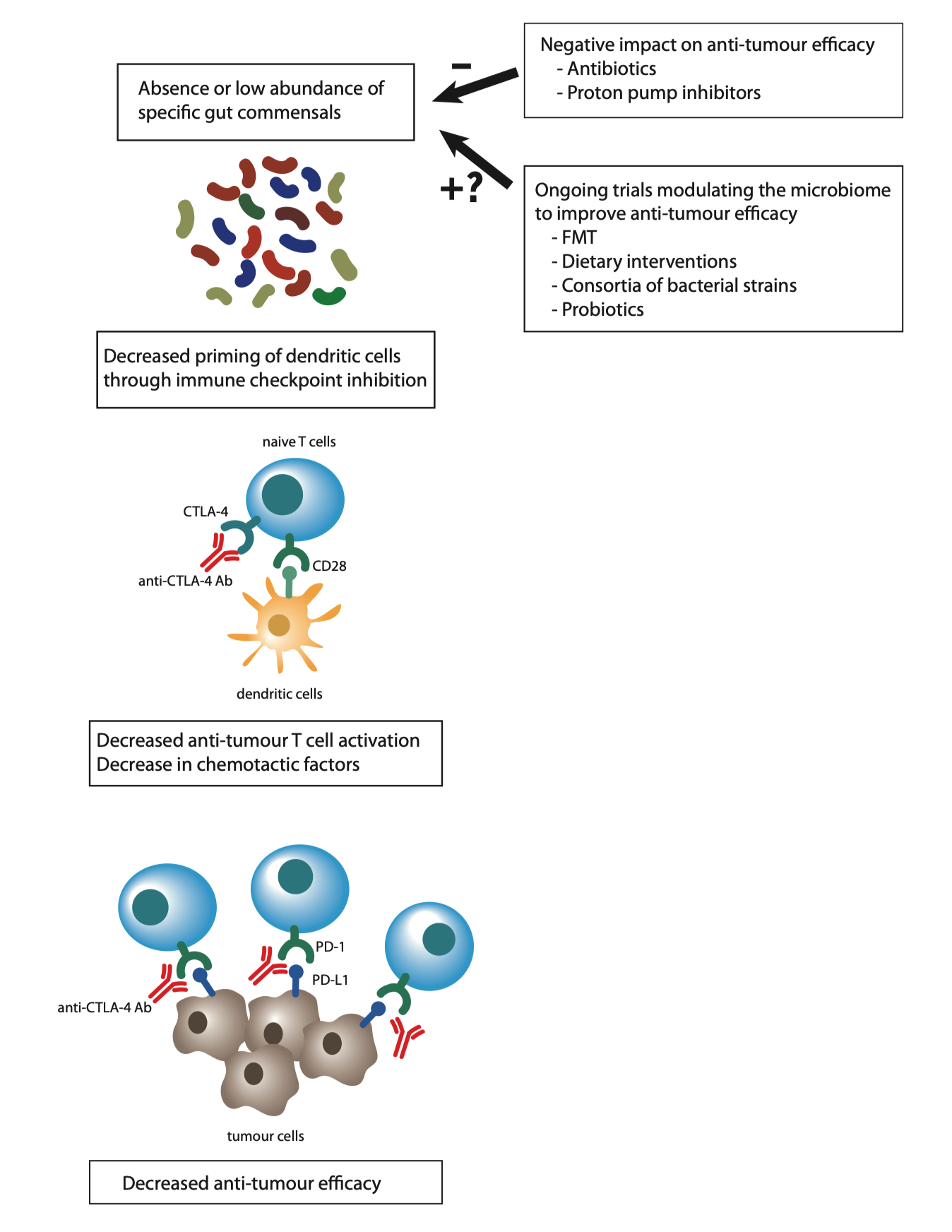
图3|肠道菌群参与调控癌症免疫治疗的临床反应
(肠道菌群在癌症免疫治疗应答中的调节作用。CTLA‑4 为细胞毒性 T 淋巴细胞抗原 4;PD‑1/PD‑L1 为程序性细胞死亡通路相关分子;FMT 表示粪菌移植疗法。)
这些发现让“个体化用药”有了新的维度——不仅取决于基因型,还取决于肠道生态型。药代动力学、药效学的模型正逐步加入菌群参数,未来医生在开处方时,可能需要同时阅读患者的肠道微生物图谱。
研究团队总结:药物与菌群的相互作用是可塑的、可干预的。通过益生菌、膳食调节或粪菌移植,或许能增强药效、减轻毒副作用。医学的未来,正在从“药理学”走向“微生态药理学”。
参考文献
Weersma R.K., Zhernakova A., Fu J. Interaction between drugs and the gut microbiome. Gut. 2020; 69(8): 1510–1519. doi:10.1136/gutjnl-2019-320204
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
