出品:科普中国
作者:郭菲(烟台大学)
监制:中国科普博览
在医学发展的漫长历史中,人类一直在寻找更早、更准确发现癌症的方法。癌症之所以可怕,很大程度上是因为早期症状不明显,等到出现明显不适时,很多患者确诊时往往已经错过了最佳治疗时机。据世界卫生组织统计,如果能在早期发现并治疗,超过三分之一的癌症是可以治愈的,另外三分之一可以通过治疗延长生命并提高生活质量。
如今,这个愿景正在变为现实。中国科学院合肥物质科学研究院核能安全技术研究所的杨良保研究员、董荣录副研究员,联合合肥肿瘤医院邓青梅等研究人员,开发出了一套革命性的智能检测系统。这个系统结合了先进的光学检测技术和人工智能算法,仅需一滴血液样本,即可同步检测六种常见的肿瘤标志物,识别准确率达到了前所未有的100%。
这项突破性成果,标志着我国在癌症早期诊断技术领域实现重要技术跨越。研究团队开发的注意力尺度融合网络(ASFN),不仅能准确识别肿瘤标志物的种类,还能精确测量其浓度,为临床医生提供了强有力的诊断支持。
更令人振奋的是,这项技术采用的是无标记检测方法——无需添加任何化学标记物或染料,直接对血清样本进行分析。在传统检测方法中,每检测一种肿瘤标志物通常需要特定的试剂盒和复杂的操作流程,而这个新系统可以一次性完成多种标志物的检测,大大提高了效率。这意味着检测过程更加简单、快速,成本也更低,让精准癌症早筛有望惠及更多人群。
血液中的“预警信号”
我们的身体就像一座精密运转的工厂,当某个“车间”出现问题时,便会释放出一些特殊的“信号分子”——对于癌症来说,即肿瘤标志物。它们就像是身体发出的求救信号,告诉我们某个地方可能出了问题。
比如,当肝脏出现癌变时,会释放一种叫甲胎蛋白的物质;胰腺癌则会产生糖类抗原19-9;卵巢癌会分泌糖类抗原125。这些物质平时在健康人体内的血液中含量极低,一旦癌症发生,其浓度就会异常升高。医生通过检测这些标志物的水平,辅助判断患者是否可能患有某种癌症。
然而,要在血液中准确找到这些标志物并不容易。打个比方,如果把血液比作一个巨大的游泳池,那么肿瘤标志物就如同滴入水中的几滴油。要在庞大复杂的血液环境中精准捕捉微量标志物,就需要极其灵敏和智能的检测手段。
光的“指纹识别术”
科学家们使用了一项名为表面增强拉曼光谱(SERS)的技术。这个名字听起来很复杂,但原理其实不难理解。
当我们用手电筒照射一个物体时,光会被反射回来。大部分反射光的颜色没有改变,但有极少部分光的颜色会发生细微变化。这种变化就像每个分子独有的“指纹”,通过分析这些光学特征,科学家就能识别出被照射的是什么物质。
为了让这个“指纹”更加清晰,研究团队使用了金纳米粒子——直径约50纳米(比头发丝还要细上千倍)微小的金颗粒。当肿瘤标志物分子吸附在金纳米粒子表面时,会产生一种叫做“表面等离子体共振”的物理现象。简单来说,金纳米粒子就像一个超级放大器,能够把原本微弱到几乎检测不到的光信号增强百万倍以上。这就如同在安静的房间里说悄悄话很难被听见,但如果拿着扩音器,即使是轻声细语也能传遍整个房间。金纳米粒子的这种增强效应,让科学家能够“看见”血液中那些极其微量的肿瘤标志物。
但新的问题又来了:血液中有成千上万种不同的物质,它们的“指纹”相互重叠,形成了一幅极其复杂的图像。如同在交响乐中分辨单一乐器的声音,难度极大。
让人工智能学会“专注”
这时候,人工智能登场了。研究团队开发的注意力尺度融合网络(ASFN),就像一位经验丰富的医生,能够从复杂的信息中快速找出关键线索。
这个AI系统的工作方式很像人类的大脑。当我们看一幅画时,不会平均地关注每个角落,而是会自动聚焦在最重要的部分。ASFN也是这样,它会自动识别光谱中最有诊断价值的区域,忽略那些无关紧要的背景噪音。
更巧妙的是,这个系统采用了“双管齐下”的策略。一个分支负责识别“这是什么肿瘤标志物”,另一个分支负责测量“浓度是多少”。就像医生先判断病人得了什么病,再评估病情的严重程度一样。
两个分支还会相互“交流”。当第一个分支确定了标志物的种类后,会把这个信息告诉第二个分支:“这是肝癌标志物,它的正常浓度范围是这样的。”有了这个提示,第二个分支就能更准确地判断浓度是否异常。
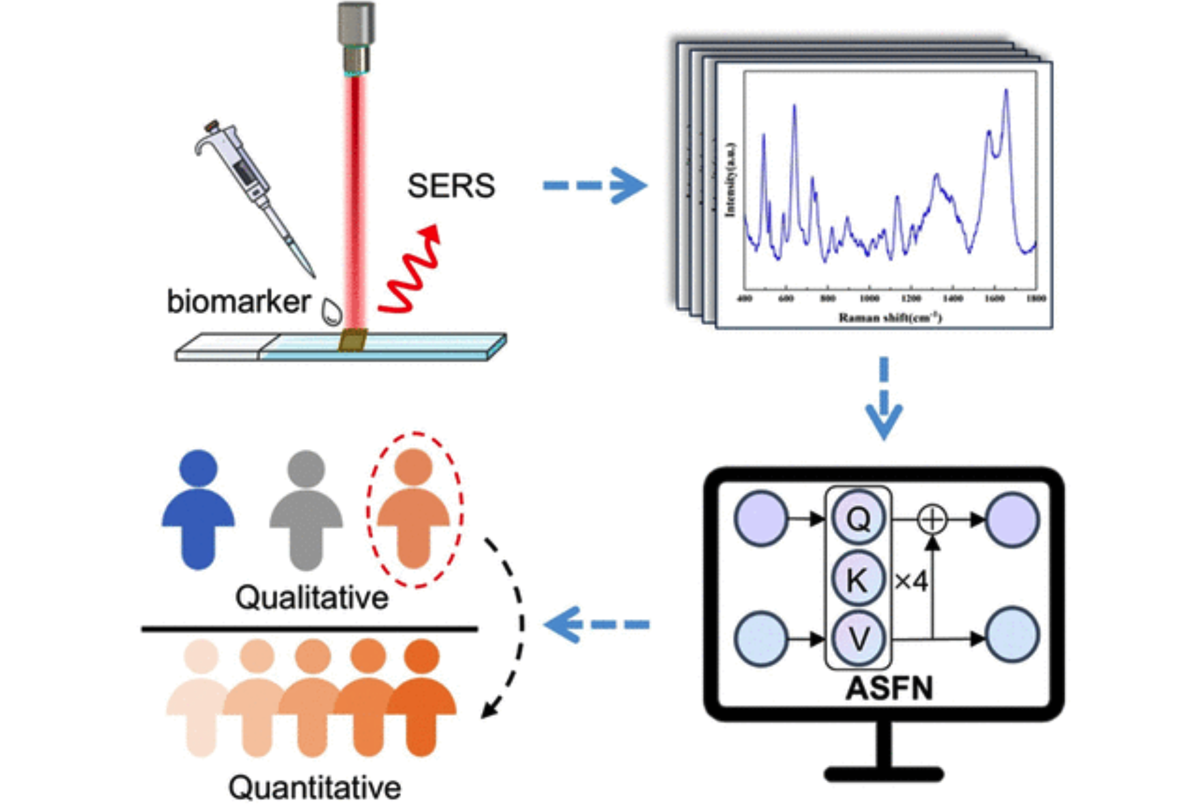
SERS 结合注意力尺度融合网络(ASFN)用于生物标志物的定性分类与定量预测的示意图
(图片来源:参考文献1)
六种癌症标志物的精准识别
研究团队选择了六种最常见的肿瘤标志物进行测试,分别是:
癌胚抗原(CEA)——主要与结肠癌、胃癌相关,就像消化系统癌症的“哨兵”。
甲胎蛋白(AFP):肝癌的重要标志,可以说是肝脏健康的“晴雨表”。
糖类抗原19-9(CA19-9):胰腺癌的“信使”,胰腺出问题时它会升高。
糖类抗原125(CA125):卵巢癌的“警报器”,女性健康的重要指标。
神经元特异性烯醇化酶(NSE):肺癌特别是小细胞肺癌的“信号灯”。
鳞状细胞癌抗原(SCCA):各种鳞状细胞癌的“标记物”。
为了训练AI系统,研究人员准备了4610个样本。每种标志物都设置了从极低到极高的15个不同浓度,尤其是在临床诊断最关注的“临界值”附近,增加了更多的测试点,让AI系统能够牢牢掌握正常与异常的界限。
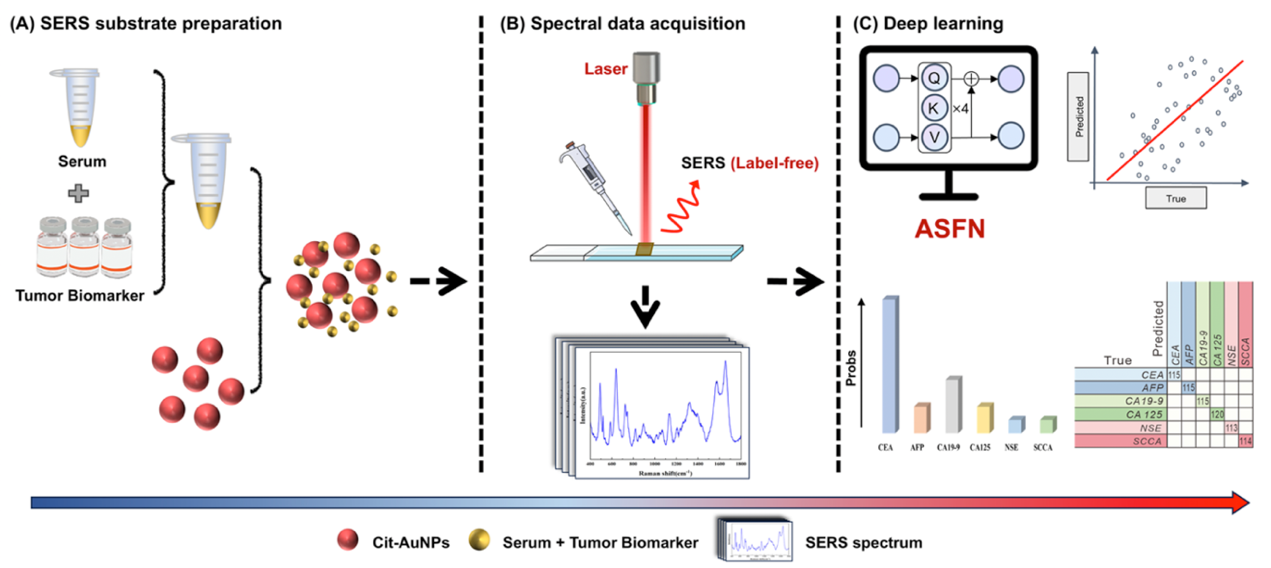
(A) 金纳米颗粒的制备及其与样品组装用于 SERS 测量的示意图;(B) SERS 光谱的采集;(C) 基于深度学习的肿瘤生物标志物分类与浓度预测
(图片来源:参考文献1)
发现关键的“密码区”
通过分析,研究团队发现了光谱中几个关键区域,这些区域如同破解肿瘤标志物身份的“密码”。
第一个关键区域(1688-1696波数)反映的是蛋白质的特征。当这个区域的信号被屏蔽后,AI的识别准确率从100%骤降至64.74%。如同蒙住了医生的一只眼睛,诊断能力大幅下降。
第二个重要区域(900-980波数)与细胞的能量代谢有关。由于癌细胞的代谢方式与正常细胞不同,会产生更多的乳酸等物质。这个区域就如同观察细胞“呼吸”的窗口。
第三个区域(1428-1436波数)反映的是细胞膜的变化。癌细胞的膜结构与正常细胞有差异,这种差异会在光谱上留下痕迹。
这些发现不仅证明了AI判断的科学性,也帮助科学家更好地理解肿瘤标志物的特征。
性能全面超越传统方法
在测试中,ASFN展现出了惊人的性能。在识别肿瘤标志物种类方面,准确率达到100%,没有一个样本被错误分类。相比之下,其他方法都有不同程度的错误:K近邻算法的准确率是94.98%,随机森林是91.54%,即使是表现不错的卷积神经网络LeNet-5,也有0.11%的错误率。
在测量浓度方面,ASFN的表现同样出色。平均误差只有16.89纳克/毫升,考虑到检测范围从0到1000纳克/毫升,这个误差相当于只有1.7%,完全满足临床诊断的需求。
打个比方,如果要测量一个100米长的操场,ASFN的误差只有1.7米,而传统方法的误差可能达到10米甚至更多。这种精度的提升,对于早期癌症诊断来说意义重大,因为早期发现往往意味着更好的治疗效果和更高的生存率。
从实验室到临床:还有多远?
虽然这项技术在实验室里表现优异,但要真正应用到医院还需要克服一些挑战。研究团队坦言,目前的实验主要使用人工配制的标准样本,真实的病人血液样本会更加复杂。不同人的体质、年龄、其他疾病等因素都可能影响检测结果。
此外,设备的小型化和成本控制也是需要解决的问题。目前的拉曼光谱仪还比较昂贵和笨重,要让基层医院都能用得起、用得方便,还需要进一步的技术改进。
但研究团队对未来充满信心。随着技术的不断进步,这种智能检测方法有望在3-5年内进入临床试验阶段。届时,一滴血、几分钟的检测,就能获得多种癌症标志物的准确信息,为医生的诊断提供有力支持。
AI医疗:开启精准诊断新纪元
这项研究是人工智能改变医疗诊断的一个缩影。通过模仿人类专家的思维方式,AI不仅能够处理海量的数据,还能发现人眼难以察觉的细微模式。更重要的是,它能够不断学习和进步,积累的经验越多,诊断就越准确。
在不久的将来,这种技术可能不仅用于癌症检测,还能扩展到其他疾病的诊断。心脏病、糖尿病、阿尔茨海默症等疾病都有其特征性的生物标志物,都可能通过类似的方法进行早期筛查。
当深度学习的智慧之光照进医学诊断的每个角落,我们有理由期待一个更加健康的未来。在这个未来里,疾病能够被更早发现、更准确诊断、更有效治疗。
科技的进步从来都不是一蹴而就的,而是无数科研工作者日复一日的努力积累。从一个简单的想法到成熟的技术,从实验室的原型到医院的设备,每一步都凝聚着智慧和汗水。但正是这些努力,让我们在与疾病的斗争中不断占据主动,为人类的健康事业开辟新的道路。
参考文献:
【1】Attention Scale Fusion Network for Qualitative and Quantitative Analysis of Serum Tumor Biomarkers Via Label-Free Surface-Enhanced Raman Spectroscopy Jiawei Chen, Boyu Wu, Yanheng Huang, Yehang Wu, Shizhuang Weng, Yan Hong, Qingmei Deng, Ronglu Dong, and Liangbao Yang Analytical Chemistry 2025 97 (33), 18217-18226 DOI: 10.1021/acs.analchem.5c03263

来源: 中国科普博览
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 中国科普博览
中国科普博览 
