在过去十年里,生酮饮食(ketogenic diet, KD)从医学治疗走向大众潮流。它以“燃脂”、“控糖”著称,却也伴随争议——同样的饮食,有人精力充沛、体脂下降,有人却疲倦、便秘、甚至肝功能异常。新近发表于 Nature Reviews Gastroenterology & Hepatology 的综述文章指出,答案可能藏在肠道里。生酮饮食并非孤立运行的代谢模式,而是与肠道微生物组成、代谢物网络和免疫信号交织成一体的生态系统。
生酮饮食通过极低碳水化合物和高脂肪的比例,使身体转向以酮体为主要能量来源。表面上,这是一个能量学过程;而在微观层面,肠道菌群则在这一过程中扮演“生态调控者”的角色。文章指出,生酮饮食可迅速改变肠道菌群结构——益生菌如 Akkermansia muciniphila、Parabacteroides distasonis 的增加与神经保护和抗炎反应相关,而某些产毒或促炎菌(如 Desulfovibrio)则被抑制。这种“微生态重塑”,不仅影响能量代谢,也可能决定 KD 的疗效与副作用。
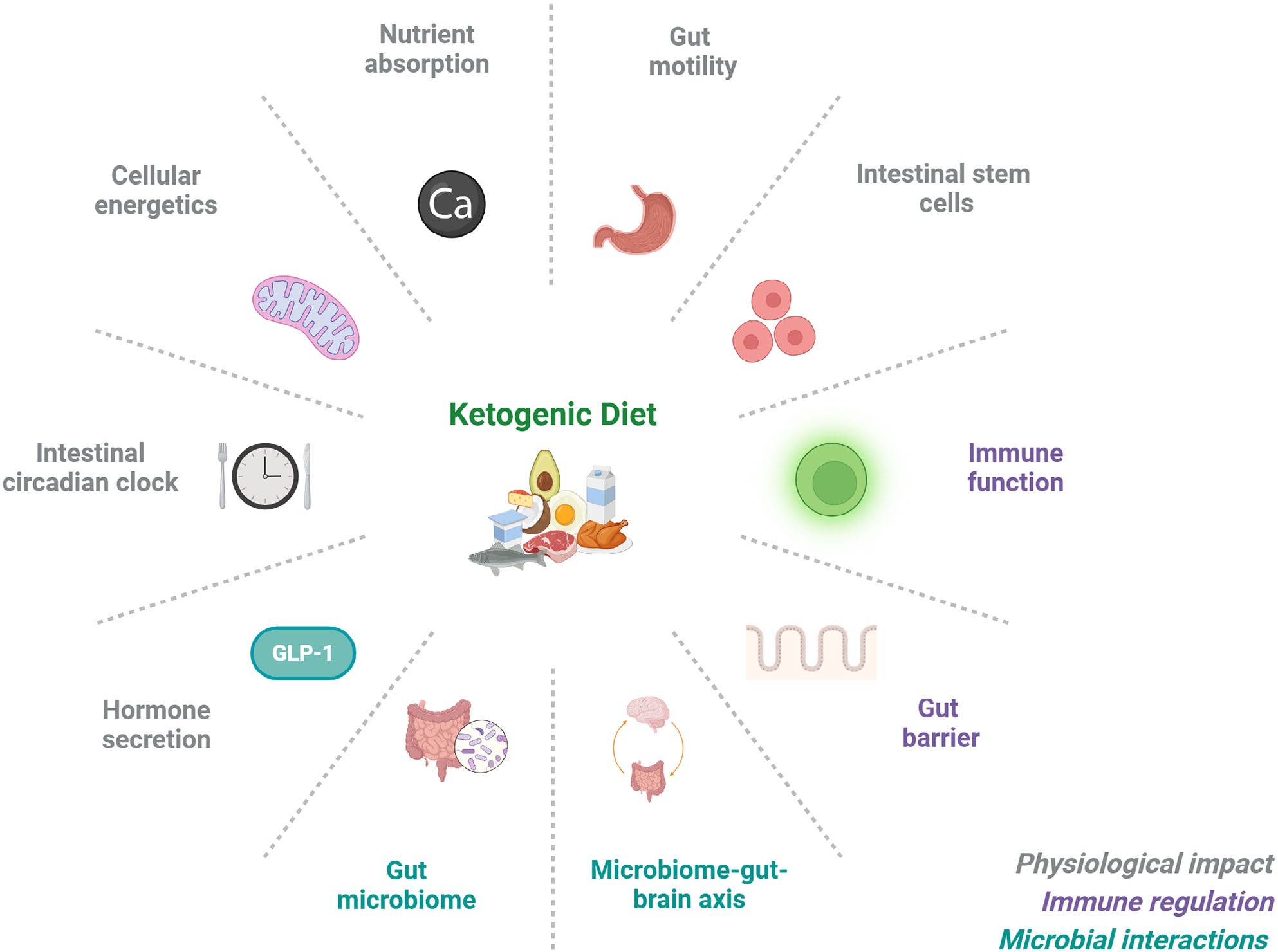
图1|生酮饮食重塑肠道菌群及其代谢网络
生酮饮食通过代谢、免疫、菌群与神经信号多通路协同作用,重塑肠道与全身生理状态。
文章回顾了多个动物与临床研究,显示生酮饮食在治疗癫痫、阿尔茨海默病、代谢综合征等方面的潜力,与肠道菌群的介入密切相关。以癫痫为例,KD 可通过提高短链脂肪酸(SCFAs)及γ‑氨基丁酸(GABA)相关代谢物的产生,抑制神经元过度放电;但若肠道菌群被破坏,抗癫痫效应也会随之消失。微生物在其中扮演的不仅是“被动响应者”,更像是药效的“协同放大器”。
与此同时,研究也揭示了 KD 的阴影面。当饮食中膳食纤维极低时,产丁酸菌减少,肠屏障功能下降,促炎信号上升,导致肠道通透性增加和系统性炎症。尤其在长期 KD 条件下,次级胆汁酸(如脱氧胆酸 DCA)的积累可能激活 FXR 与 TGR5 通路,造成肝脂肪变性与胰岛素抵抗。这种“代谢悖论”说明:并非所有生酮都健康,它的成败取决于肠道生态能否维持平衡。

图2|生酮饮食对肠道结构与功能的多维调节
生酮饮食在调节能量与食欲的同时,也会改变肠道吸收、运动与屏障功能,需要平衡营养与副作用
研究者提出,“生酮—肠道轴”(KD–gut axis)是理解饮食反应个体差异的关键枢纽。肠道菌群不仅影响 KD 的代谢路径,还可能改变能量分配:某些菌株通过调节脂肪酸氧化与酮体生成,提高能量利用效率;另一些则促进胆汁酸循环,使肝脏承担更高的代谢负担。由此产生的代谢产物,既能作用于局部肠上皮,也能经血液循环影响脑、肌肉与免疫系统。
更令人关注的是 KD 对神经系统的双向作用。文章指出,肠道微生物通过色氨酸代谢产物(如吲哚、犬尿酸等)与神经递质代谢耦合,进而影响情绪与认知。部分动物实验显示,KD 可降低肠道致炎菌比例,从而减少脑内小胶质细胞活化,实现“肠—脑轴”的抗炎稳态效应。但若菌群失衡,则可能诱发焦虑、情绪波动,甚至削弱 KD 的神经保护潜力。
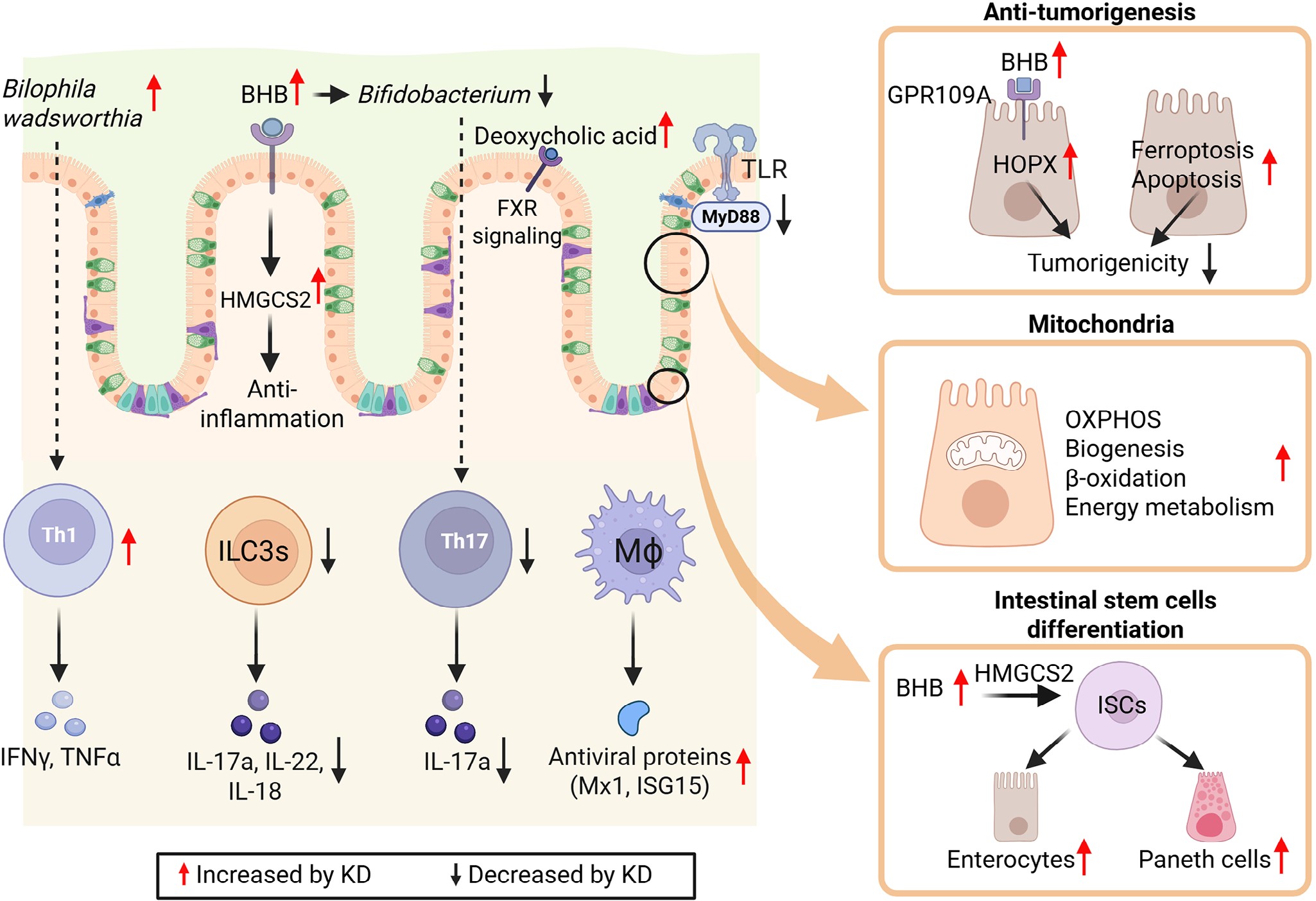
图3|生酮饮食对肠道微生物群的影响及其系统后果
生酮饮食显著改变肠道菌群生态,既可能带来神经代谢益处,也需警惕长期微生态失衡风险
文章最后提醒,未来的“精准生酮”应当超越碳水比例与脂肪比例的讨论,而转向微生物与代谢信号的定量管理。研究者提出几个可行方向:一是通过补充益生菌或益生元,缓冲 KD 引发的菌群失衡;二是利用多组学数据识别“响应型菌群”,实现个体化饮食设计;三是监测血酮与微生物代谢物双指标,以判断 KD 的安全阈值。真正的生酮革命,不在厨房,而在肠道实验室。
这篇综述让我们看到,饮食并非孤立的选择,而是一场生态谈判。肠道微生物是这场对话的译者、监督者,也是参与者。生酮饮食的“健康”与“风险”,其实是肠道在平衡能量与炎症的结果。 当我们重新理解肠道,不再只是消化器官,而是生命生态的核心,或许就能让“生酮”成为一条通往健康的更稳妥的路径。
参考文献
C. Mu, J. Shearer. The interplay between the gut and ketogenic diets in health and disease. Advanced science. 2025. DOI: 10.1002/advs.202504249
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
