生酮饮食(Ketogenic Diet, KD)被许多人奉为“燃脂神器”:低碳水、高脂肪的组合让身体从燃烧糖转向燃烧脂肪,以酮体作为能量来源。然而,这种“代谢切换”并不总是健康的。最新发表在 Gut Microbes 的研究显示,当肠道菌群被扰动,原本用来控糖减脂的生酮饮食,反而可能引发肝脏脂肪堆积与代谢紊乱。
研究团队来自四川农业大学与四川大学,他们发现肠道微生物并不是被动的旁观者,而是调控肝脏酮体生成和脂质代谢的核心力量。在小鼠模型中,当抗生素清除肠道菌群后,再喂以生酮饮食,动物表现出更严重的高酮血症(hyperketonemia)和肝脂肪沉积。换言之,缺乏正常肠道菌群的“生酮”不但不健康,还可能让肝脏陷入“燃脂过度”的反噬。
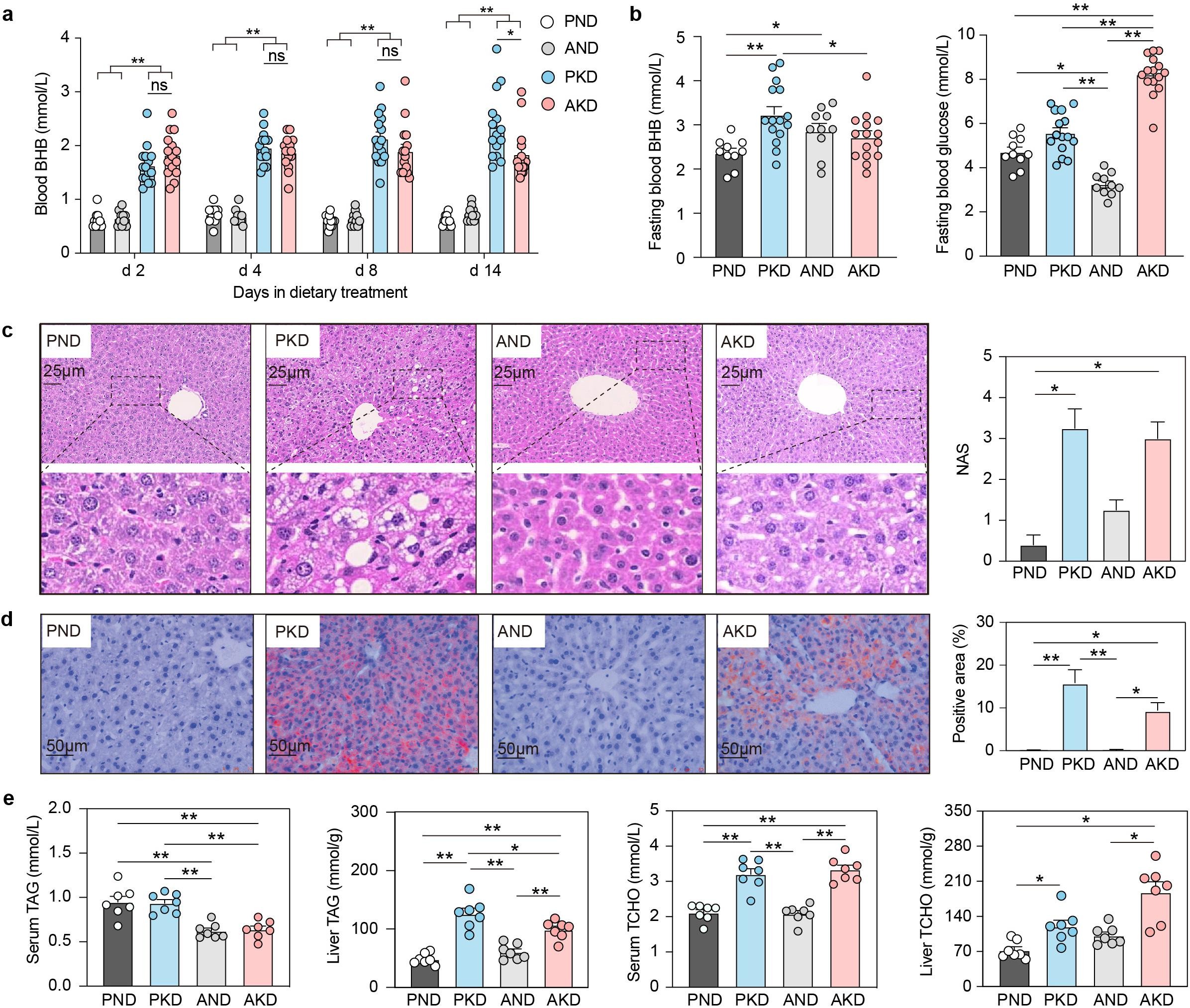
图1|生酮饮食下肝脏酮体生成与脂质堆积的变化
通常情况下,限制碳水摄入会促使肝脏通过“酮体生成”(ketogenesis)路径产生β‑羟基丁酸(BHB),作为能量替代物。这一过程在短期内可改善胰岛素敏感性和体重控制,但若持续刺激,酮体浓度升高可能转为病理状态,导致肝脏脂肪堆积、胰岛素抵抗,甚至炎症。研究者发现,长期 KD 饮食使血液 BHB 浓度显著上升,同时肝脏内甘油三酯(TAG)含量同步增加;而抗生素处理组的变化更为剧烈,暗示肠道菌群缺失放大了 KD 的不良代谢效应。
更令人意外的是,罪魁祸首之一竟是一种常见的共生细菌——产气荚膜梭菌(Clostridium perfringens)。在健康状态下,它只是肠道生态中的一员,但在高脂低碳的生酮环境中,它“变脸”为代谢扰动者。研究发现,该菌通过干扰胆汁酸代谢,将脱氧胆酸(DCA)大量转化为一种名为 12‑酮脱氧胆酸(12‑ketoLCA)的次级胆汁酸。这种代谢产物反过来激活肝脏的 FXR 与 PPARα 信号通路,使得酮体合成与脂肪生成同时被“踩下油门”,形成了一个矛盾循环——身体在燃烧脂肪的同时,也在制造新的脂肪。
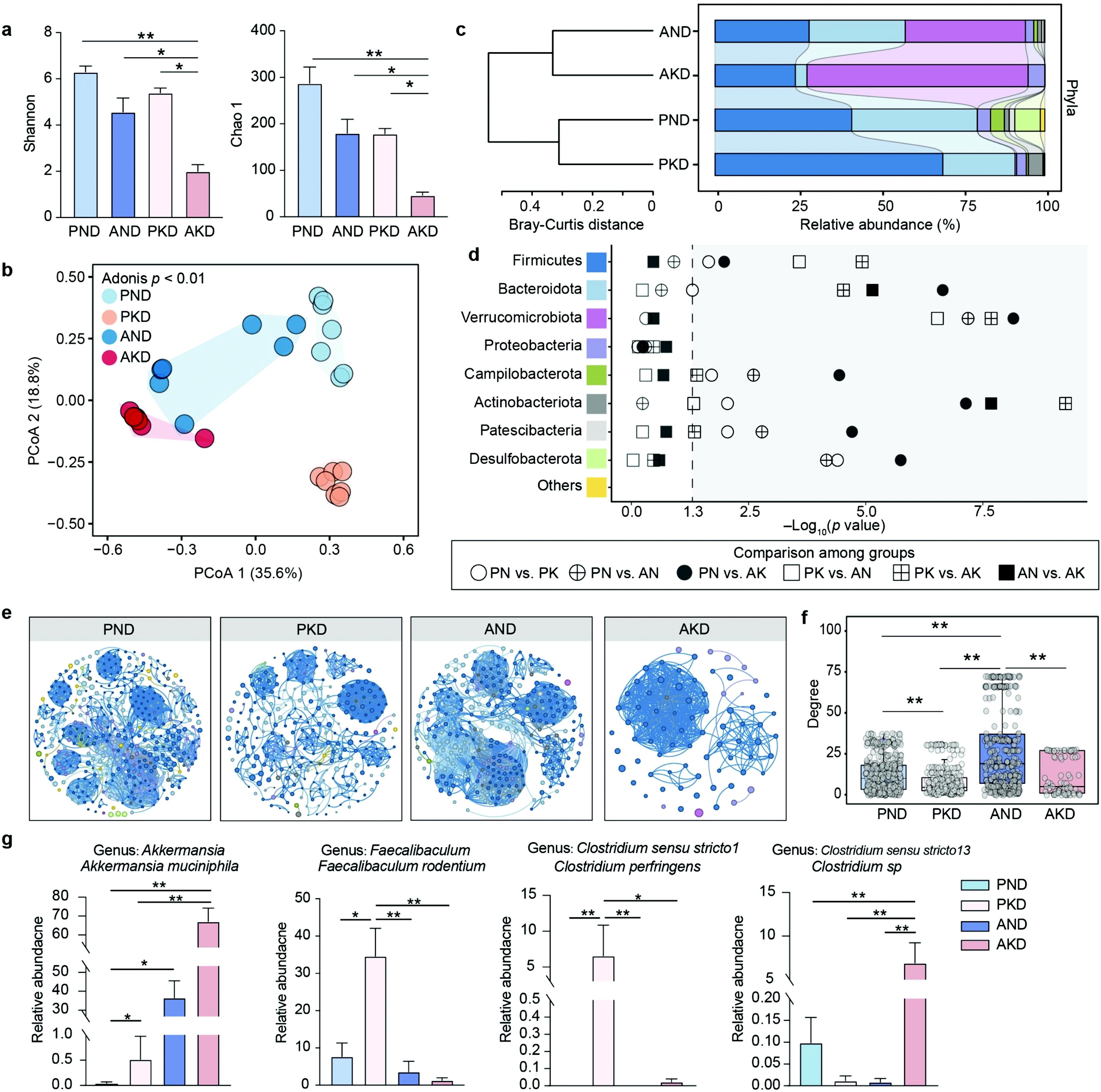
图2|生酮饮食会破坏肠道微生物群的重塑。
为了确认这种因果关系,研究者进一步做了一个跨物种的“粪菌移植”实验(FMT)。他们将来自高酮血奶牛与正常奶牛的肠道菌群分别移植到无菌小鼠体内,再喂以相同的生酮饮食。结果令人印象深刻:接受“高酮菌群”移植的小鼠血酮水平更高,肝脂肪堆积更严重,相关基因如 DGAT2、HMGCS2 和 BDH1 的表达均被显著上调。这一结果强烈暗示,肠道菌群的结构差异足以决定个体对生酮饮食的代谢反应。
随着实验的深入,科学家们逐渐描绘出一个复杂的“肠—肝轴”模型:生酮饮食改变了肠道生态,肠道菌群反过来通过次级胆汁酸调节肝脏的代谢开关。特别是产气荚膜梭菌引发的 12‑ketoLCA 生成增加,成为连接肠道变化与肝脏代谢失衡的关键纽带。研究还发现,这种变化不仅促进酮体生成,也强化了甘油三酯的合成途径,使肝脏同时处于“产酮”和“储脂”的矛盾状态。
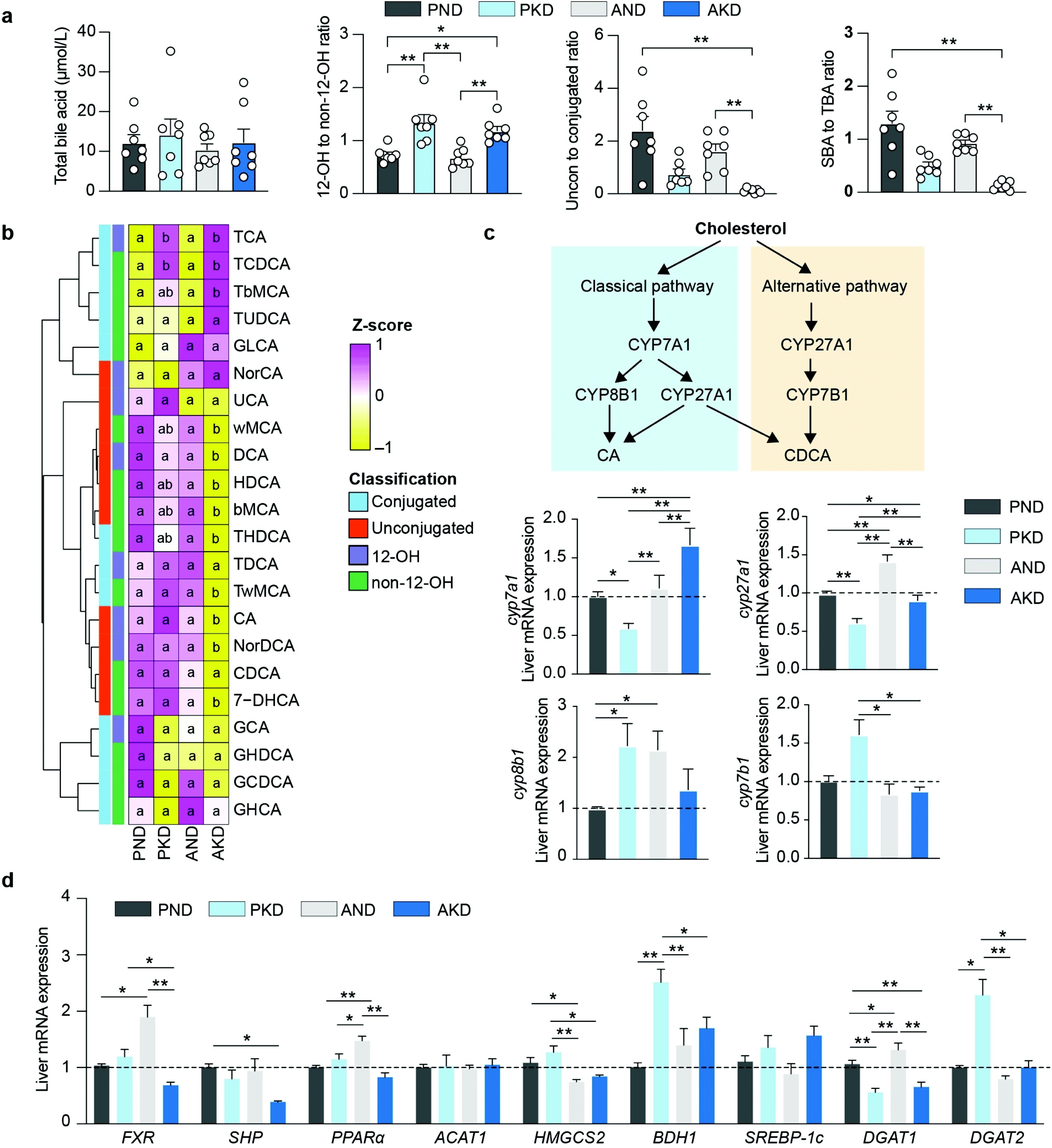
图3|肠道菌群-胆汁酸-肝脏代谢的相互作用示意
这一发现让人重新审视“生酮饮食等于健康”的想法。肠道菌群原本应在高脂状态下维持代谢平衡,但当生态被打破——无论是因为抗生素使用、长期单一饮食,还是过度节食——胆汁酸代谢通路便会失控。其结果是:肝脏在过度生酮的同时陷入脂质过载,甚至出现炎症迹象。科学家们指出,这种机制在动物模型中已被清晰验证,而在人群中也有类似线索,提示某些个体在实行 KD 时容易出现“反向代谢”。
因此,真正的关键不在“生酮吃得多精”,而在“肠道生态够不够稳”。 未来的营养干预或许不再仅仅关注宏量营养素比例,而是要结合个体肠道菌群特征,调整能量与胆汁酸的循环平衡。换句话说,想让“生酮”真正精准、持久、安全,也许要从肠道开始。
这篇研究为生酮饮食的科学应用敲响了警钟。它提醒我们:燃脂的火焰若缺乏微生物的调节,可能烧到自己的肝脏。要让生酮饮食成为健康工具而非代谢陷阱,理解并尊重体内那片微小世界,或许才是最聪明的选择。
参考文献
1.Luo Z, Huang Y, Yong K, Wu D, Zheng L, Yao X, Shen L, Yu S, Wang B, Cao S. Gut microbiota regulates hepatic ketogenesis and lipid accumulation in ketogenic diet-induced hyperketonemia by disrupting bile acid metabolism. Gut Microbes. 2025;17(1):2496437. doi:10.1080/19490976.2025.2496437.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
