我们习惯把“营养”理解为食物中的能量与养分,却忽略了它抵达身体真正作用前,必须经过一个沉默的“翻译者”——肠道微生物群。最新发表在 Nature Reviews Gastroenterology & Hepatology 的综述文章指出,人类营养科学正在经历一场“微生物转向”:从单纯研究食物与代谢,到理解食物如何经由微生物被重新定义、转译、甚至放大或削弱其效应。肠道菌群,正在成为连接饮食与健康的“分子桥梁”。
长期以来,我们把饮食效果的差异归因于基因、生活方式或环境,但研究者发现,即使是基因几乎相同的个体,对同样饮食的反应也可能截然不同——例如,有人摄入高纤维饮食后血糖平稳,有人却依旧升高。原因在于:营养与疾病之间的关系,往往是通过肠道菌群这个“中间层”实现的。 它既能代谢纤维生成短链脂肪酸,也能将胆汁酸、氨基酸等转化为信号分子,重新塑造肝脏、脂肪组织与免疫系统的代谢格局。
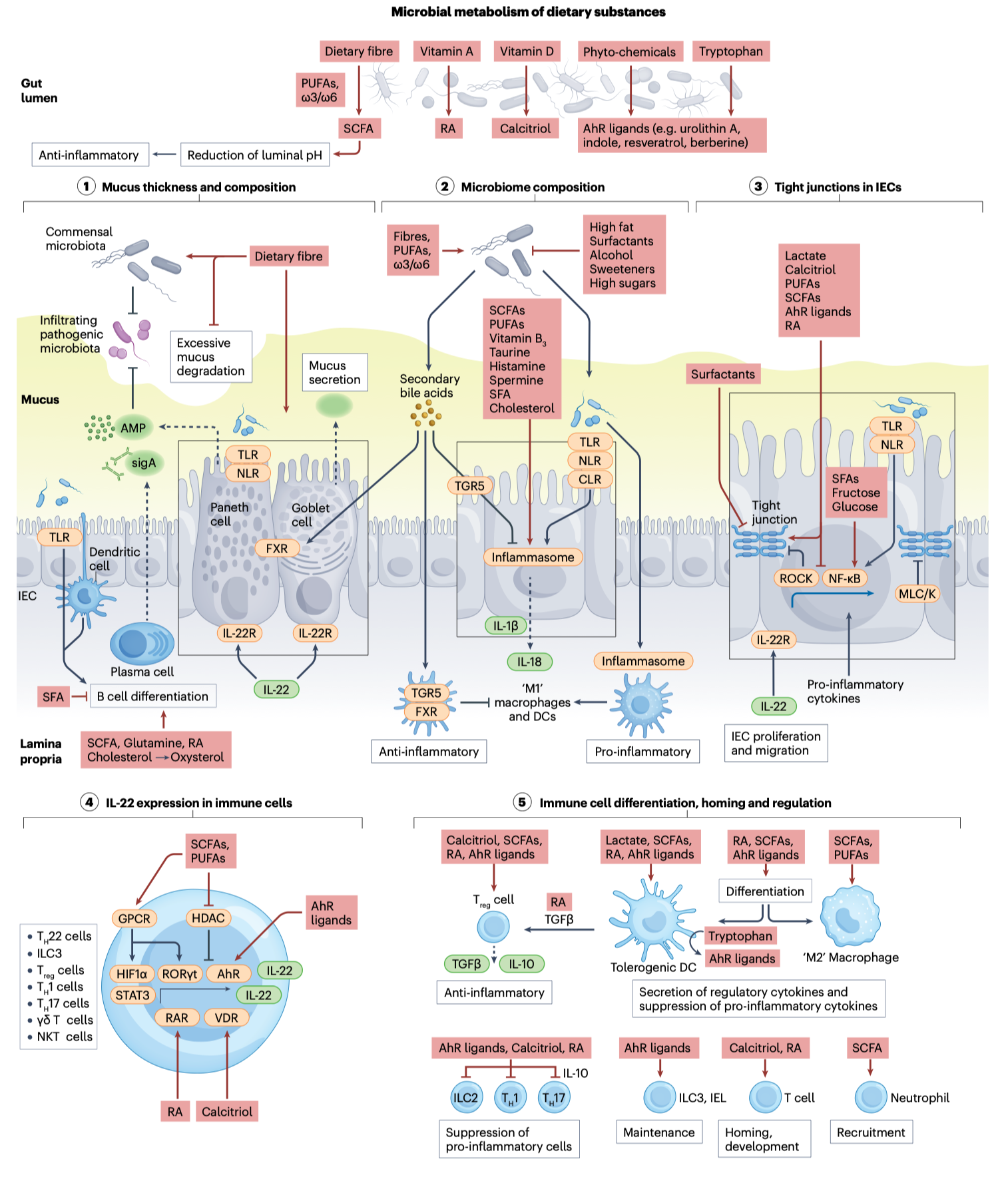
图1|肠道微生物是营养与健康的连接枢纽
肠道微生物是饮食与宿主代谢健康之间的关键“中介”——通过代谢碳水、蛋白、脂质、胆汁酸等营养物质,调节能量代谢、炎症和激素信号。
文章指出,肠道微生物与营养的关系并非简单的“吃什么养什么菌”,而是一个动态的生态反馈系统。饮食中的多糖、蛋白、脂肪被不同菌群分工消化,生成数以千计的代谢物。这些代谢物如短链脂肪酸(SCFAs)、吲哚衍生物、酚类化合物、次级胆汁酸等,能穿越肠上皮,与宿主受体结合,触发代谢与免疫信号通路。肠道就像一个分子工厂,它生产的化学语言在身体各系统间流通,调控能量平衡与免疫稳态。
例如,丁酸(butyrate)可促进上皮细胞能量代谢并抑制炎症;吲哚衍生物通过芳烃受体(AHR)维持肠屏障完整;而胆汁酸转化产物则能激活 FXR、TGR5 等受体,影响胰岛素分泌与脂质代谢。这些“菌源信号”不仅解释了不同饮食的健康差异,也揭示了为什么某些营养干预在部分人群中无效——不是食物没效,而是“翻译者”不同。

图2|肠道菌群通过神经、内分泌和免疫途径影响大脑与情绪
肠道菌群通过神经、免疫和激素三重信号,影响大脑功能与情绪——饮食可通过调节菌群来“重塑情绪与精神健康”。
更深层的启示在于,肠道微生物不仅“解释”营养,还能“创造”营养。许多维生素、氨基酸和共因子都依赖微生物合成;而在能量受限或疾病状态下,菌群代谢产物甚至成为替代能源或信号调节因子。研究者因此提出,肠道微生物是人体的“外源器官”——它参与碳、氮、硫循环,是营养学与生理学不可分割的一部分。
然而,这种复杂的交互也意味着风险。高脂、低纤维的饮食可迅速削弱菌群多样性,诱发促炎菌扩张;抗生素的滥用则可能摧毁这一生态平衡,使原本保护性的代谢信号转为病理性。文章提醒,营养干预若忽略肠道生态,就可能南辕北辙。 例如,高蛋白饮食在部分人中可导致蛋白发酵菌增殖,释放氨与硫化氢,加重肠屏障损伤与代谢炎症。

图3|肠道菌群失衡下的代谢与免疫紊乱
健康饮食(富含纤维、维生素、PUFAs)通过肠道菌群代谢产物维持屏障完整性和免疫平衡;而西方饮食破坏屏障并诱发慢性炎症。
值得注意的是,这篇综述还强调了“精准营养(precision nutrition)”的新方向:通过测量个体的菌群结构与代谢产物谱,预测其对特定食物的反应,并制定更具针对性的饮食方案。与传统的“膳食金字塔”不同,这种模式基于个体生态特征——同一份燕麦,有人降糖,有人升糖;同一杯酸奶,对某人是护肠,对另一人却无效。未来的营养处方,或许会像药物一样,需要肠道菌群的“共识”。
综观全文,这篇综述像是一场观念重塑:营养不再仅仅是摄入的“量”,而是与微生物共生的“语法”。我们吃的每一口,不只是喂饱身体,更是在与体内的微生物对话。 食物的意义,正被肠道重新定义——那是一个微观但极其活跃的世界,它用化学语言讲述健康的故事。
参考文献
Sonnenburg JL, Turnbaugh PJ, Clemente JC. The gut microbiome connects nutrition and human health. Nature Reviews Gastroenterology & Hepatology. 2025. doi:10.1038/s41575-025-01077-5.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
