癌症的防治,不止是手术、化疗或免疫疗法的较量。越来越多的证据表明,肠道微生物群正悄然参与这一场复杂的战争。
肠道菌群——这些与我们共生的“隐形器官”——不仅影响免疫系统的活性,还能通过代谢物、信号通路甚至药物分解能力,左右癌症的发生与治疗反应。然而,问题在于:每个人的肠道都不一样。同样一份饮食,对不同的人可能是保护,也可能是风险。
这正是《Cell Host & Microbe》上最新综述提出的突破点:用人工智能(AI)为每个人建立一个“数字肠道孪生体”(Digital Gut Twin, DGT)。
它不只是一个模型,而是一个会学习、会更新的虚拟“肠道克隆人”,能够模拟个体的微生物组成、饮食反应和肿瘤免疫变化,从而预测——在癌症防治中,什么吃法才真正“对你有效”。
传统的营养干预往往基于群体统计:高纤饮食有益,地中海饮食更健康。然而现实更复杂。研究发现,即便是同卵双胞胎,他们的肠道菌群构成、短链脂肪酸代谢与免疫信号反应都可能完全不同。
在这种个体差异面前,统一的饮食建议就像“盲人摸象”。
AI的介入,正是为了解决这种生物复杂性的计算难题。
研究者提出的“数字肠道孪生体”可以整合五类数据:微生物组、饮食记录、宿主组学、临床资料以及生活方式信息。
通过模拟肠道菌群在不同饮食输入下的代谢变化,它能预测个体对某种饮食的反应——例如高纤饮食是否能促进抗肿瘤免疫,或高脂饮食是否会增加炎症信号。
这些模拟背后的“引擎”,是AI对复杂生物网络的建模能力。研究者采用知识图谱、语言模型、贝叶斯网络与强化学习等方法,让AI在大量数据中推断“食物—微生物—代谢产物—免疫反应”的多维关系。例如,模型可以计算出增加可溶性膳食纤维后,Faecalibacterium prausnitzii 的丰度上升概率为75%,并进一步预测其提高免疫治疗应答的可能性。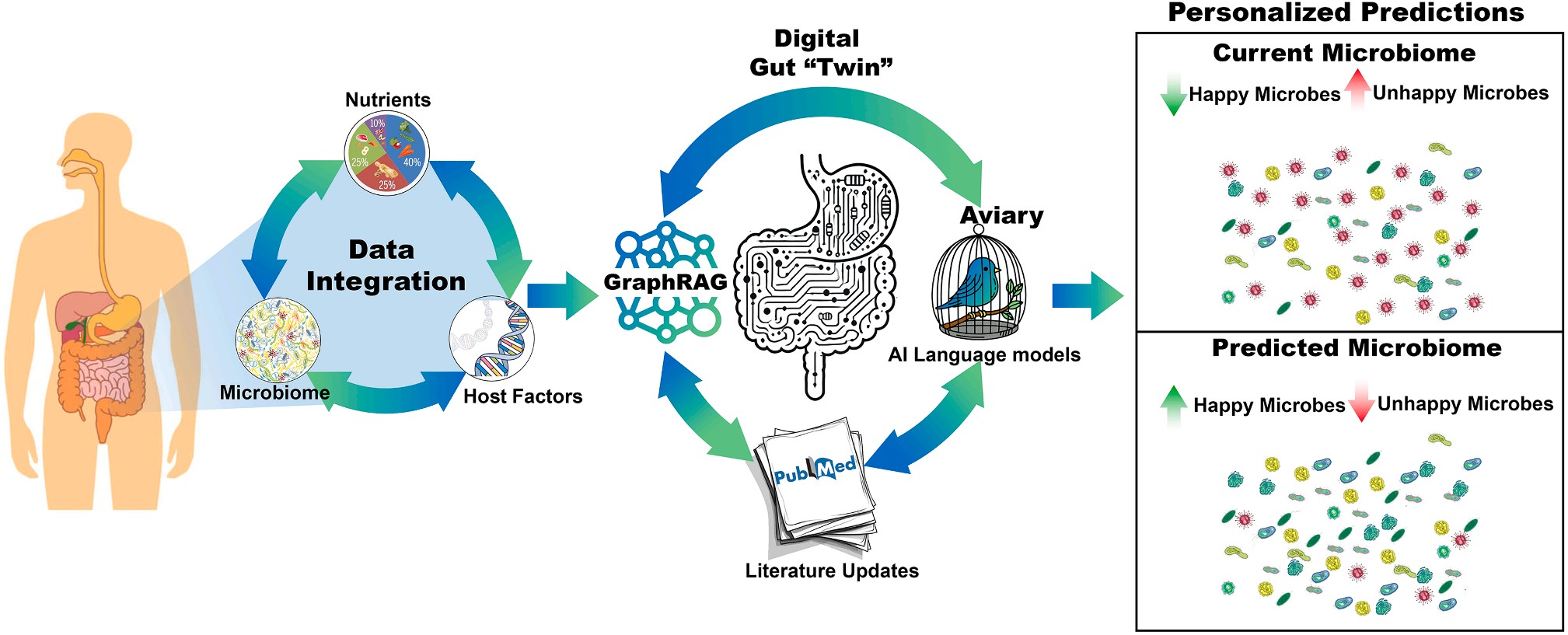
图1|数字肠道孪生的建模框架
这项系统不仅能“预测”,还能“学习”。当患者的饮食与微生物检测数据不断更新时,AI模型会自动调整参数,就像自动驾驶汽车根据道路实时修正路线。科学家称之为强化学习循环:AI在虚拟环境中尝试不同饮食组合,评估其对肠道菌群与肿瘤免疫的影响,再反哺到现实建议中。
例如,对一位接受免疫检查点抑制剂治疗的结直肠癌患者,系统发现其Akkermansia muciniphila 丰度较低,而这类菌与良好疗效密切相关。DGT便可模拟在“高果胶饮食+益生菌补充”方案下,是否能提高免疫细胞的活化水平。若模型预测肿瘤抑制反应显著,临床医生即可有依据地推荐该饮食策略。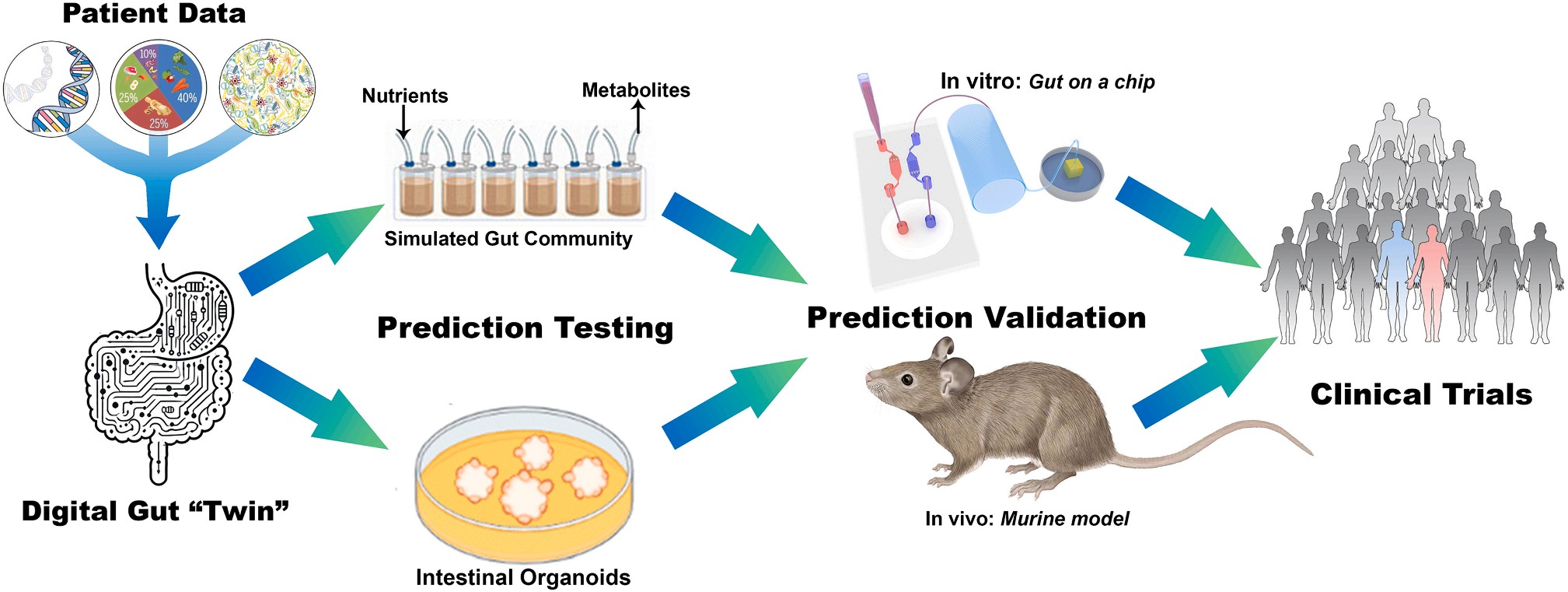
图2|数字肠道孪生的验证与转化路径
从本质上看,数字肠道孪生正让“饮食即药”变得可计算、可验证、可个体化。它不仅能预测饮食对癌症治疗的辅助效果,还能提前识别潜在风险——例如某种高脂饮食可能导致有害胆汁酸上升,从而促进肿瘤进展。
然而,要让它真正进入临床,还需跨越诸多挑战:从数据标准化、模型可解释性,到隐私保护与伦理监管。研究者指出,未来的关键在于构建全球多样化数据集、发展因果推理AI、并通过“人机共审”的临床试验确保模型可信。
换句话说,AI能帮助医生和营养师走出经验主义的迷雾,让每个人的餐桌,真正成为自己的精准处方。
参考文献
Greathouse, K. L., & Choudhury, A. (2025). Precision nutrition and the gut microbiome: Harnessing AI to revolutionize cancer prevention and therapy. Cell Host & Microbe, 33(6), 766–776. https://doi.org/10.1016/j.chom.2025.05.011
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
