在过去十年里,癌症免疫治疗——尤其是 PD-1、CTLA-4 等免疫检查点抑制剂——被视为现代医学最耀眼的进展。然而,它并非万能:超过半数患者对治疗无反应,部分人甚至出现严重副作用。2025 年发表在 Nature Reviews Drug Discovery 的综述文章指出,也许答案藏在我们体内最古老的伙伴——肠道微生物群。
研究者发现,免疫疗法的疗效与患者肠道菌群的组成密切相关。响应者体内往往富含 Akkermansia、Bifidobacterium 和 Faecalibacterium 等菌群,它们能增强 T 细胞活性、促进抗肿瘤免疫;而非响应者则常被致炎菌主导,如 Bacteroides 或 Fusobacterium。更令人震惊的是,移植“有应答者”的粪菌,能让“无应答者”的小鼠重新获得疗效。这意味着,菌群的状态可以决定药物的命运。
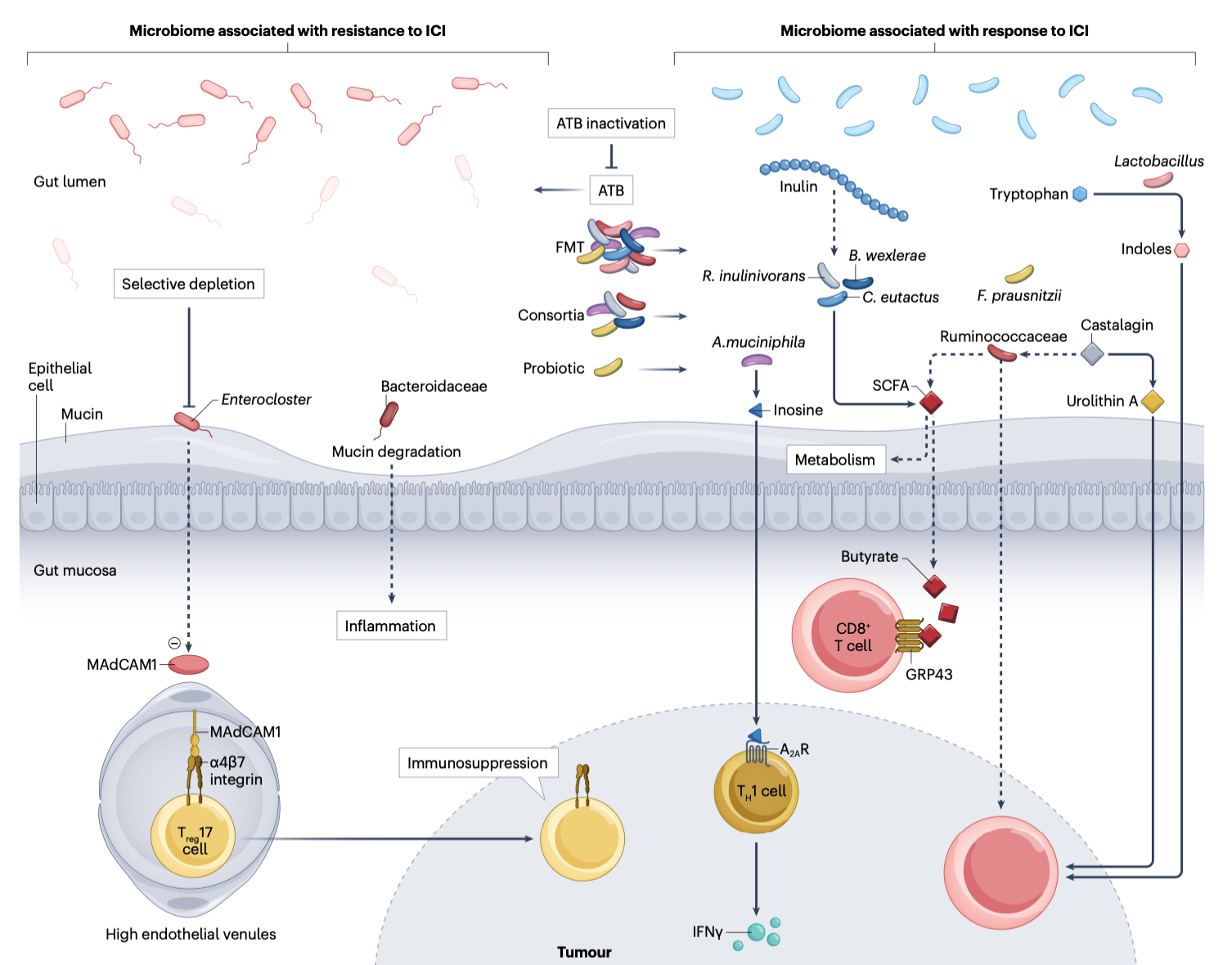
图1|肠道菌群与免疫疗法应答之间的多层关联
这篇综述提出了一个大胆的构想:把肠道菌群视为新的药物靶点。传统药物以蛋白、受体或通路为目标,而未来的药物研发或许将以“微生物群生态”为基础,通过干预菌群组成、代谢或信号,间接调控免疫系统。
目前,科学家正探索几条并行路径。最直接的是 粪菌移植(FMT),它已在多项临床试验中显示出改善免疫疗法应答的潜力。相比之下,合成微生物群(synthetic consortia) 则更具工程化思路:利用数株经过筛选或改造的菌株,以可控、可复制的方式重建健康微生态。另一方向是 工程化益生菌——让特定菌株在肠道中持续分泌免疫调节因子或代谢物,如丁酸盐、吲哚衍生物等,以强化抗肿瘤免疫。
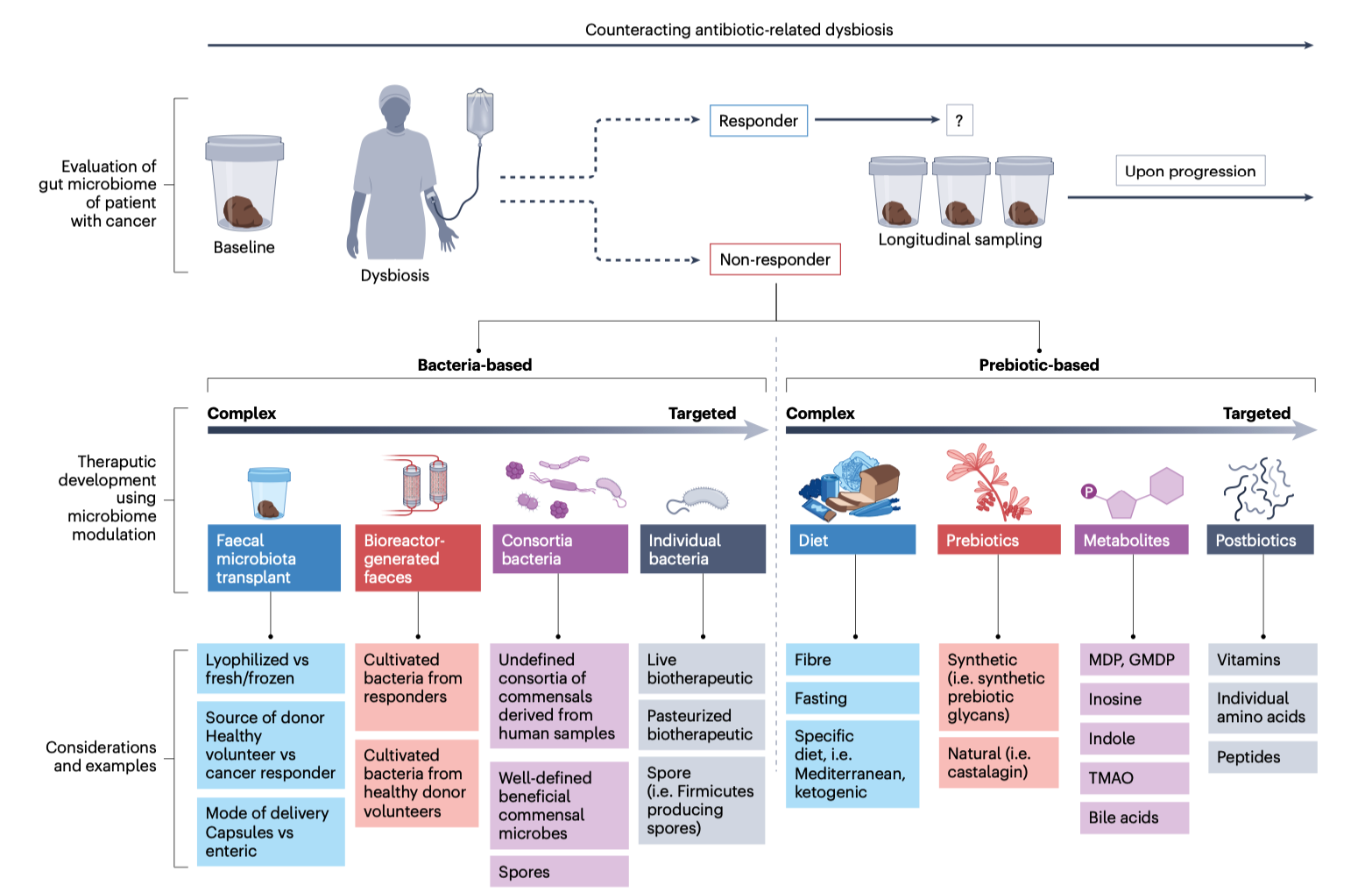
图2|肠道菌群干预的多种药物开发策略
然而,将微生物“药物化”并非易事。首先是个体差异——每个人的肠道菌群都独一无二,甚至一天之内也会波动,这让临床标准化极为困难。其次是机制不确定性——菌群如何具体影响免疫反应,仍是一个多层次谜题。第三是监管与安全性:菌群干预涉及“活体生物制剂”,监管框架尚在建立中。如何确保菌群制剂既有效又可控,成为药企和监管机构面临的新挑战。
综述指出,未来的突破可能来自多学科融合。人工智能可用于筛选菌株与代谢物,系统生物学能描绘微生物—免疫互作网络,而精准营养学则通过饮食干预配合菌群疗法。最终目标,是让每位患者的菌群成为可编程的“免疫伴侣”。
正如作者所言,癌症免疫治疗的第一场革命让免疫系统成为武器,而第二场革命,正在让肠道微生物成为“军师”。当药物、菌群与宿主免疫形成三方联盟,我们或许才真正接近“个体化治愈”的边界。
参考文献
The gut microbiome as a target in cancer immunotherapy: opportunities and challenges for drug development. Nature Reviews Drug Discovery (2025). doi.org/10.1038/s41573-025-01211-7
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
