癌症的故事,往往从基因突变写起。但越来越多的证据提醒我们:有时,故事的序章其实藏在肠道。2023 年发表在 Nature Reviews Cancer 的综述《Gut microbiota in cancer initiation, development and therapy》指出,肠道微生物群不只是被动的旁观者,它既可能在癌症的诞生中“推波助澜”,也可能在治疗中成为“秘密盟友”。这一发现,正在重塑人们对“癌症起点”的理解。
科学家早已知道肠道菌群会影响代谢、免疫与炎症,但过去十年的研究把这种影响描绘得更为精细。论文将菌群的作用分为三个层次:癌症的发生(initiation)、发展(progression)与治疗反应(therapy)。在这三个阶段,微生物既可以成为风险因子,也能化身保护屏障。
在癌症“发生”的起点,肠道菌群可能扮演诱发者的角色。部分细菌通过产生基因毒性分子(如 colibactin、cytolethal distending toxin)直接损伤 DNA;另一些则通过诱导慢性炎症,让细胞在高氧化应激的环境下不断突变。举例来说,结直肠癌患者体内常见的 Fusobacterium nucleatum 不仅能促进肿瘤形成,还能干扰抗癌免疫;而 Escherichia coli 某些株系则携带致突变基因岛,长期定植可推动癌变。
与之相对,有益菌群则像“防火墙”。Akkermansia muciniphila 能强化肠黏膜屏障,阻止炎症信号外溢;Faecalibacterium prausnitzii 通过产生丁酸盐抑制 NF‑κB 通路,从而降低癌变风险。于是,在一场漫长的共生与背叛之间,癌症的第一颗种子悄然埋下。
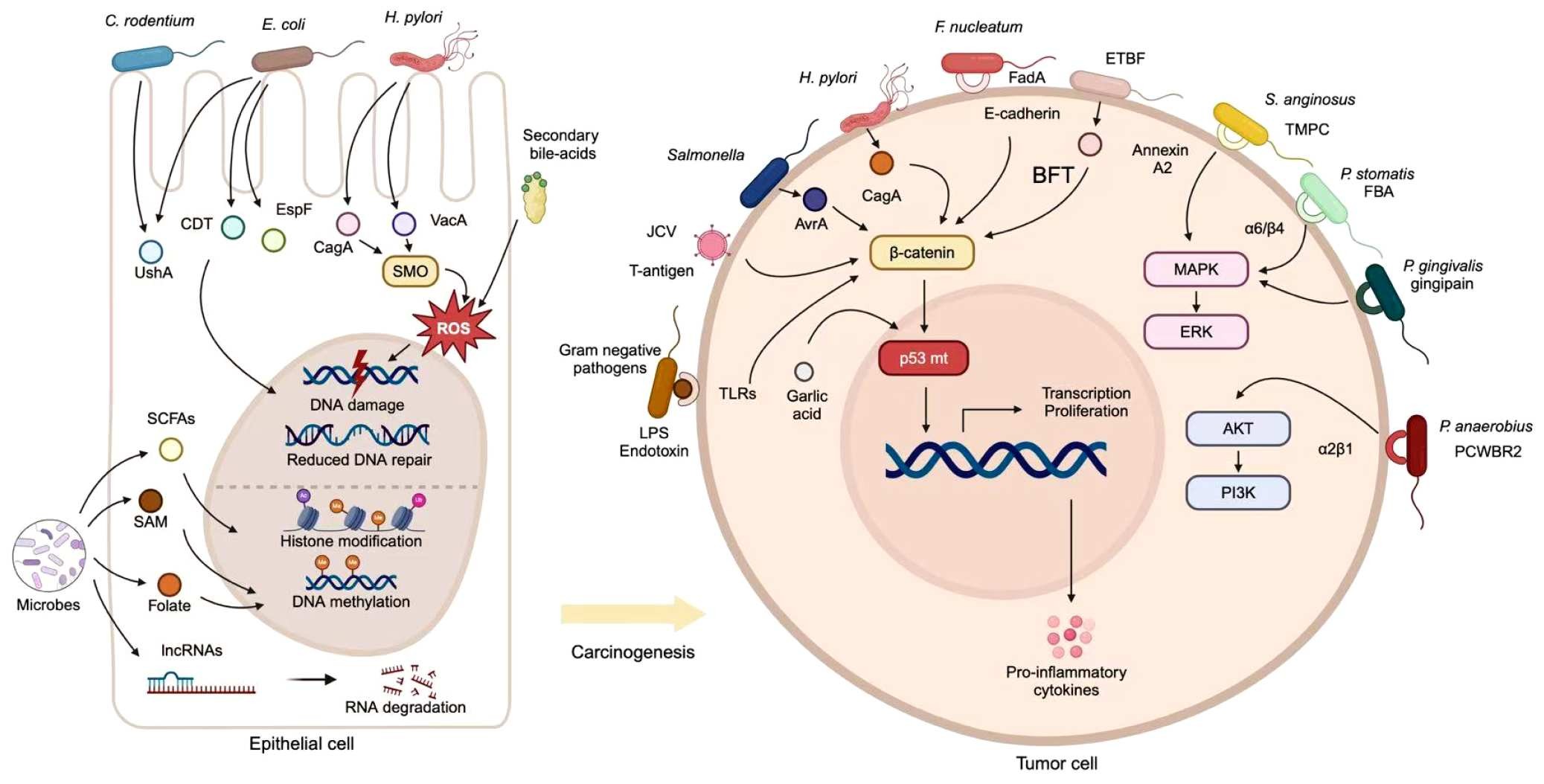
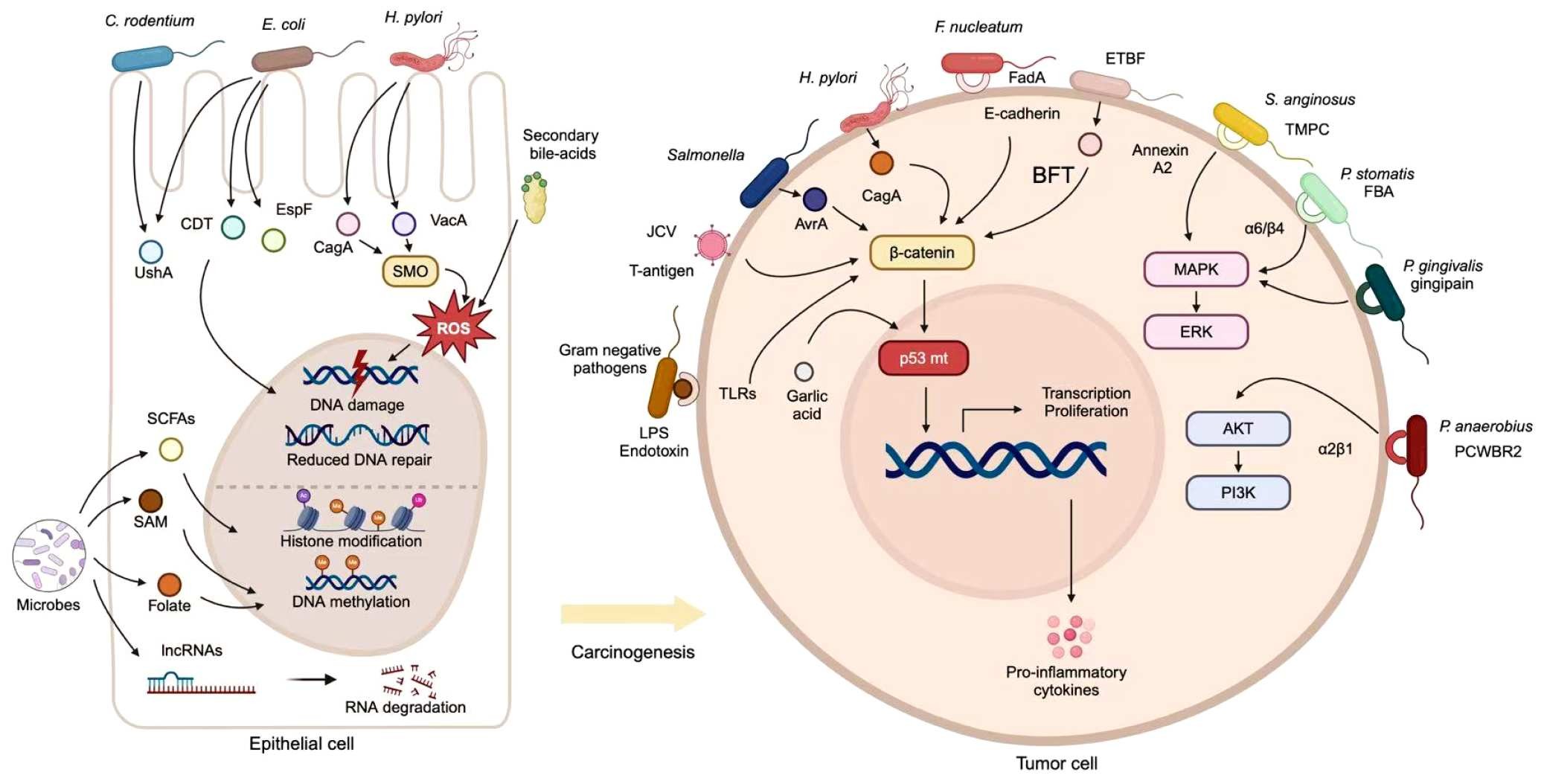
图1|涉及微生物群促进的致癌和癌症发展的分子机制。肠道微生物群可能通过介导遗传或表观遗传改变,以及激活致癌信号通路,对癌症的发生和发展做出贡献。
当肿瘤进入“发展”阶段,微生物的影响不再局限于肠道本身。肠源代谢物、脂多糖和细菌 DNA 片段可以通过循环系统扩散至远处器官,塑造所谓的“系统性前转移生态位”。在肝癌与胰腺癌模型中,这种远程信号已被证明能调节骨髓来源免疫细胞的迁移与活化,提前为肿瘤“布防”。有趣的是,这一过程并非单向破坏:肿瘤自身也会反过来改变宿主菌群,使其更符合癌细胞的生存需要。换句话说,癌症与菌群之间存在一种互为因果的“生态共谋”。
与此同时,饮食、抗生素与化疗等外部因素也不断扰动这一平衡。高脂饮食和广谱抗生素会削弱菌群多样性,让“坏菌”有机可乘;而某些化疗药物(如环磷酰胺)则依赖菌群代谢激活免疫反应。微生物与药物之间的互动,正在成为解释疗效差异的关键拼图。
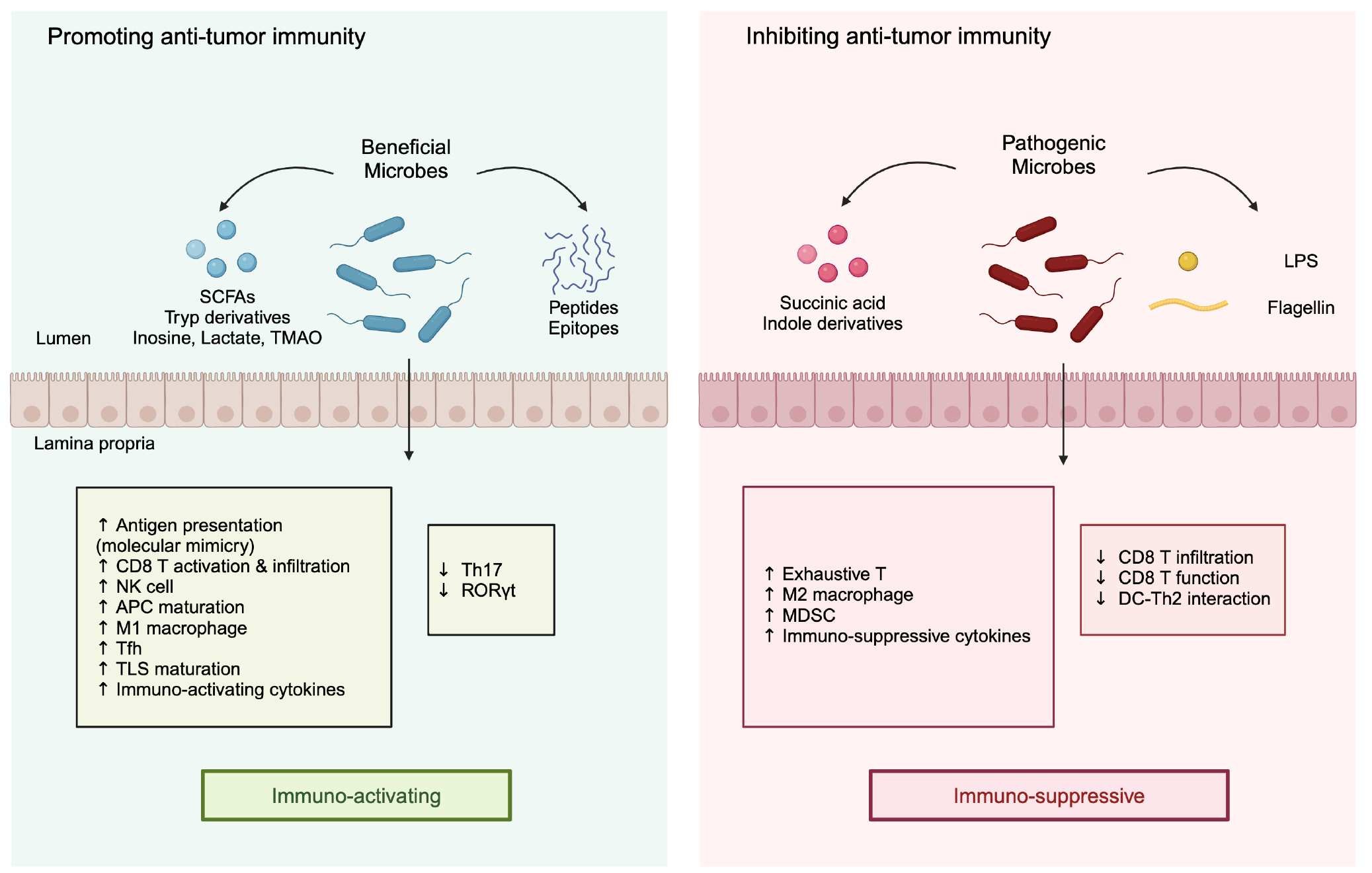
图2|肠道菌群对调节抗肿瘤免疫的影响。肠道菌群可以启动特定的局部免疫反应,这些反应可能支持或阻碍肿瘤生长。
当视线转向“治疗”阶段,故事开始变得更令人振奋。肠道菌群不但影响化疗、放疗与靶向药物的代谢,还能决定免疫检查点抑制剂(ICIs)的疗效。研究显示,对 PD‑1 抑制剂有应答的患者体内,往往富含短链脂肪酸产生菌和黏膜修复菌;而耐药患者的菌群则以炎症型与产毒型细菌为主。这为粪菌移植(FMT)打开了新的应用方向——通过移植“应答者菌群”,让无效的免疫疗法重新奏效。Science 与 Nature Medicine 已分别报道了相关临床结果,为“菌群调控抗癌”提供了直接证据。
更前沿的尝试正在出现:科学家正开发基因编辑的“智能益生菌”,能在肿瘤微环境中定向释放抗炎或免疫激活分子;还有研究利用微生物代谢工程,生产增强 T 细胞活性的代谢物。这些“菌‑药结合”策略,让肠道微生物从被动变量变成可控变量。
综述的结语写道:“理解肠道微生物群与癌症的互作,是迈向精准肿瘤治疗的关键。”未来的肿瘤科或许会多出一个新角色——“微生态科”。医生除了查看影像与分子标志物,还会检查患者的菌群谱,决定是否需要益生菌、饮食干预或粪菌移植。癌症的根不一定生在肠道,但肠道的确有能力改变癌症的走向。
参考文献
Helmink BA, Kostic AD, Wargo JA. Gut microbiota in cancer initiation, development and therapy. Nature Reviews Cancer. 2023; 23(3):174-190.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
