科学界一直在追问一个问题:为什么同样的免疫检查点抑制剂(PD-1 抗体),对某些癌症患者奏效,却在另一些人身上几乎无反应?2018 年,《Science》发表的研究首次提出答案——关键可能藏在肠道。
研究团队发现,部分患者的抗 PD-1 疗法失败,与其肠道菌群的异常组成有关。更令人惊讶的是,当他们把“应答者”的粪便移植给原本无效的小鼠,后者重新恢复了对免疫治疗的敏感。追踪分析显示,一种名为 Akkermansia muciniphila(阿克曼氏菌) 的细菌,是这一逆转的关键角色。
这篇发表于《European Urology》的专家评论进一步揭示了背后的机制。A. muciniphila 是一种黏液层中的“隐形清道夫”,能分解膳食多糖并释放短链脂肪酸(SCFAs),尤其是丙酸盐(propionate)。这些分子并非仅仅为肠上皮供能,它们还是信号分子,通过结合两类 G 蛋白偶联受体(GPR41 和 GPR43),在癌细胞与免疫细胞之间建立起一条化学通信通道。
丙酸进入细胞后,会抑制组蛋白去乙酰化酶(HDAC),促使染色质结构松弛,从而激活 p21 等抑癌基因的表达,让癌细胞停留在 G1 期并走向程序性死亡。这一过程伴随多条“死亡信号”的启动——IAP 家族蛋白表达下降,caspase-3、6、7、8 的连锁活化启动细胞凋亡。换句话说,肠道细菌的代谢产物,正通过表观遗传学手段让癌细胞“自毁”。
与此同时,SCFAs 对免疫系统的影响同样深远。它们能在结肠的调节性 T 细胞中激活 mTOR-S6K 与 STAT3 通路,促进 Th1、Th17 及 FoxP3⁺ 等多种免疫亚群的生成;丙酸还能诱导血管内皮细胞上 ICAM-1 与 E-selectin 的表达,为 T 细胞开辟通往肿瘤的通道。
这意味着,一个看似局部的代谢事件,最终可能在全身层面增强免疫细胞的“作战动员”,让原本沉睡的免疫疗法重新奏效。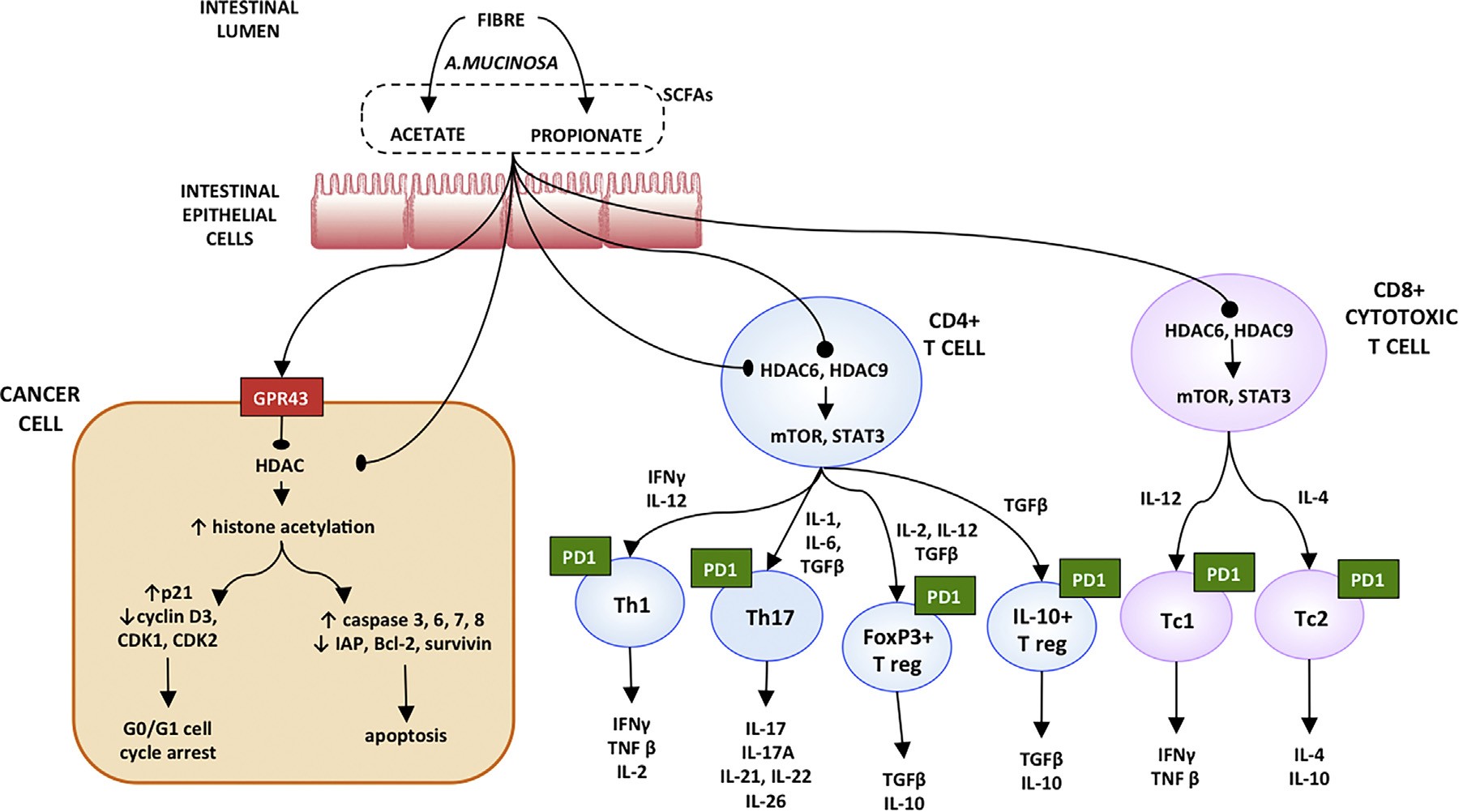
图1|微生物如何恢复免疫检查点抑制剂反应的模型
这种跨越“肠-免疫-癌”三重界面的机制,为解释免疫治疗的个体差异提供了生物学依据。以往我们把免疫检查点抑制剂的反应性视为肿瘤基因或免疫微环境问题,而这项研究提醒我们:免疫疗法的钥匙或许并不在肿瘤,而在肠道。
更重要的是,A. muciniphila 的作用并非孤立。它与饮食结构、膳食纤维以及其他共生菌密切相关。高纤维饮食可为其提供底物,促进 SCFA 的生成;而抗生素或高脂饮食则可能破坏这一链条,使免疫疗法功亏一篑。因此,未来的癌症治疗或许不仅是药物的优化,更是“药+菌+食”的系统工程。
虽然目前仍处于早期探索阶段,但科学家已着手开发基于 A. muciniphila 或其代谢产物的辅助疗法,希望通过益生菌或靶向代谢调控提高 PD-1 疗法的应答率。它们也许无法取代药物,却可能成为精准免疫治疗的催化剂。
从微观的丙酸分子,到宏观的免疫系统,这条由微生物铺设的路径,让我们重新理解了人类与体内微生物的共生关系:有时,打赢癌症,不只是靠免疫系统有多强,而在于肠道是否在“同一阵线”。
参考文献
Santoni M., Piva F., Conti A., et al. (2018). Re: Gut Microbiome Influences Efficacy of PD-1-based Immunotherapy Against Epithelial Tumors. European Urology. https://doi.org/10.1016/j.eururo.2018.05.033
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
