在免疫治疗改变肿瘤治疗版图的十年里,PD‑1 抑制剂带来了持久生存的可能,但现实也一直提醒我们:并非所有患者都能被点燃。对于那些对 PD‑1 早期即无应答的黑色素瘤患者,传统思路往往把目光投向肿瘤突变负荷、PD‑L1 表达或 T 细胞功能本身,而 2021 年的一项 Science 临床研究把问题搬回了肠道——当我们把“应答者”的菌群移植给“耐药者”,免疫引擎是否还能重新轰鸣?
研究设计非常克制。入组对象是确认为 PD‑1 原发耐药的转移性黑色素瘤患者,供者来自对 PD‑1 治疗获得长期缓解的“超级应答者”。受者通过结肠镜接受一次性粪菌移植(FMT),当日联合帕博利珠单抗(Pembrolizumab)并按既定周期维持。这样的组合旨在回答一个单纯的问题:当宿主的“生态土壤”被改造,原本失效的免疫药物能否再度有效。
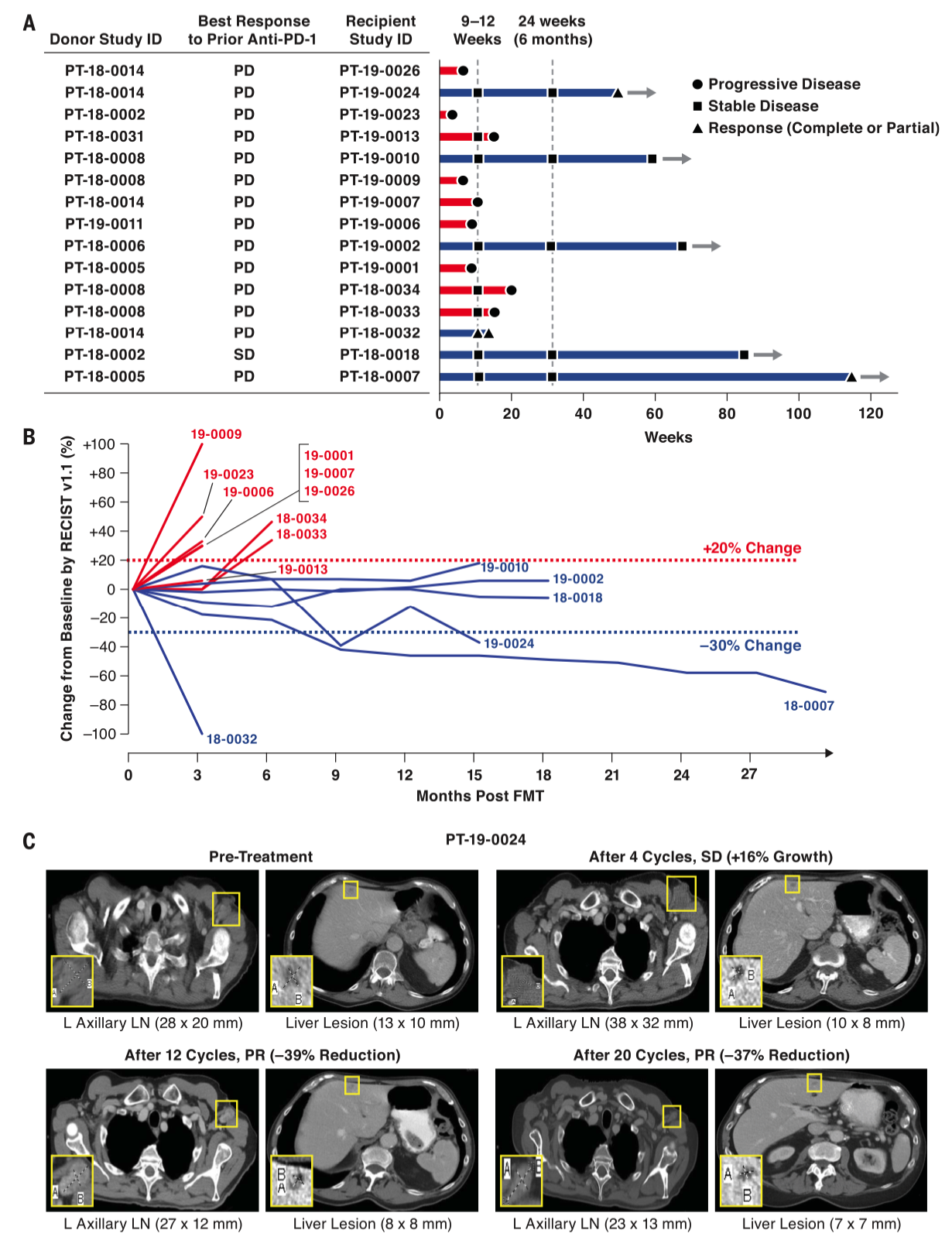
图1|临床设计与反应全貌
临床结果给出谨慎但清晰的信号。15 名可评估患者中,3 名出现客观缓解,其中包括 1 例完全缓解,另有 3 名实现持续超过 12 个月的疾病稳定。把这些人统一放在“临床获益”的框里,大约是 40%。不良反应以 1–2 级为主,可管理的内分泌改变居多。比数字更具解释力的是“定植”这件事:在出现临床获益的个体里,肠道微生物群迅速而持久地向供者结构靠拢;而在无应答人群中,这种改变要么短暂要么干脆失败,甚至会被中途使用的抗生素直接“打回原形”。
多组学的证据把这一生态—免疫的关联描画得更细。菌群层面,应答者体内更容易出现被多项研究反复指认的“免疫友好型”菌群:Faecalibacterium prausnitzii、Akkermansia muciniphila、Ruminococcaceae 与 Lachnospiraceae 等,而与炎症与免疫抑制相关的 Bacteroides 则相对退场。代谢层面,血清次级胆汁酸与芳香族化合物代谢产物(如马尿酸途径相关标志物)升高,提示肠源代谢网络被重新布线。免疫层面,外周 CD8⁺ T 细胞与黏膜相关 MAIT 细胞呈现出更活跃的表型,肿瘤组织内抑制性 IL‑8⁺ 髓系细胞与调节性 T 细胞比例下降,而 CD8⁺ T 细胞上与抗原呈递/活化相关的基因(如 CD74、GZMK)上调。换句话说,肠道生态的位移,伴随的是代谢图谱的翻页与肿瘤微环境的“改写”。
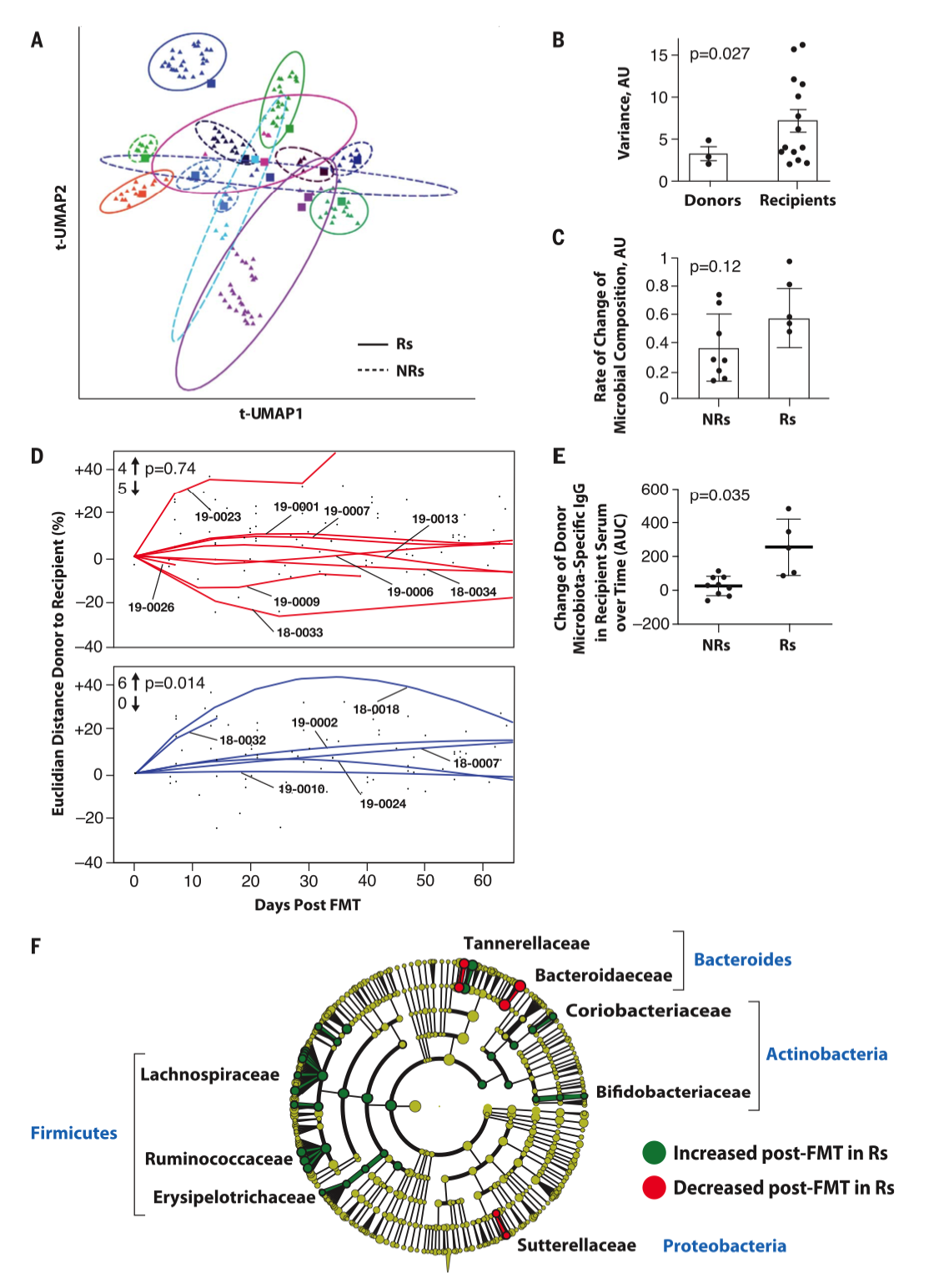
图2|粪菌移植前后,菌群组成的时序变化
如果说临床缓解与长期稳定证明了“能否有效”,那么关于“为何有效”,研究者提供的是“跨界网络”的一幅全景。把宏基因组、蛋白质组、代谢组与流式免疫表型组合进同一张图,核心的连接点落在微生物节点上:它们与多种循环因子、代谢物之间存在密集的正负相关关系,其中 IL‑8 所代表的免疫抑制造成分与“有益菌群”呈负相关。这种网络级别的线索,与影像学缓解和免疫激活的观察相互指向,提示肠道菌群不只是旁观者,而可能是驱动者之一。
当然,所有令人振奋的结果都必须与边界条件同框呈现:这是一项单臂、样本量有限的探索性临床试验,只有一部分患者被“唤醒”;成功的必要条件似乎包括供者谱系中含有“有效组合”、受者具备免疫可塑性、以及关键的——移植物要成功“落地生根”。不成功的原因也被作者一一点出:肿瘤本身缺乏免疫原性、供者组合不匹配、或定植失败。也因此,下一步更大规模、随机对照的研究将需要把“谁更可能受益”的问题回答得更可迁移。
把视角拉回科普语境,这项工作真正改变的是“治疗靶点”的地理位置:当药物不再只从肿瘤或免疫细胞本体寻找突破,而是改造宿主与微生物的共生生态,我们开始拥有第三种杠杆。它不是替代 PD‑1,而是在某些患者中让 PD‑1 “有土可用”。对临床一线的启示也很具体:谨慎选择供者、避免不必要的抗生素暴露、监测定植与代谢标志物的动态,可能构成这种“生态增敏疗法”的基本功。
参考文献
Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti–PD‑1 therapy in melanoma patients. Science. 2021;371(6529):595‑602. doi:10.1126/science.abf3363
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
