过去十年,免疫检查点抑制剂(ICIs)重绘了癌症治疗的版图。阻断 PD‑1、PD‑L1 或 CTLA‑4 的抗体,让免疫系统重新识别并攻击肿瘤。然而,即使在效果最突出的黑色素瘤和非小细胞肺癌中,仍有超过一半的患者无应答或早期耐药。eBioMedicine 于 2024 年发表的综述《Fecal microbiota transplantation: no longer Cinderella in tumour immunotherapy》指出,也许我们忽略了一个“隐形器官”——肠道微生物群。
这篇来自天津医科大学团队的论文认为,粪菌移植(FMT)正从感染性疾病的“灰姑娘”,走向肿瘤免疫治疗的“新主角”。越来越多证据表明,肠道菌群不仅能预测免疫治疗反应,还能直接参与调控抗肿瘤免疫。通过重建微生物群落、调整代谢产物与免疫细胞互作,FMT 正在以一种“生态疗法”的姿态,改变免疫治疗的底层逻辑。
肠道微生物群被称为人体的“超级器官”,它以代谢产物和免疫信号双重方式参与肿瘤的发生与治疗。研究发现,益生型菌群如 Akkermansia、Faecalibacterium、Ruminococcaceae 的增加,与免疫治疗获益呈正相关,而某些以 Bacteroidales、Proteobacteria 为主的炎症型菌群,则往往与耐药或毒副反应有关。肠道菌群似乎在“决定”免疫系统是激活还是沉睡。
FMT 由此被视为最直接的“生态重启”工具。相比单株益生菌或饮食干预,它能在一次移植中转移整个微生物生态系统,更接近真实的人体菌群状态。Science 于 2021 年报道的两项里程碑式临床试验(Davar et al. 和 Baruch et al.)首次在人类中证实,将应答者的菌群移植给 PD‑1 耐药患者,可让约 40% 的人重新出现抗癌反应。在此基础上,后续综述汇总了多种癌种(黑色素瘤、非小细胞肺癌、肾癌、消化系统肿瘤)的早期数据,显示 FMT 能提升菌群多样性、改善代谢网络,并伴随免疫细胞谱的重新编程。
在机制层面,FMT 的作用路径逐渐清晰:
●一是重塑肠道生态的多样性与稳定性,让菌群恢复“共生平衡”;
●二是调控代谢产物,如短链脂肪酸(SCFAs)和微生物来源的嘌呤类分子,这些物质能增强 CD8⁺ T 细胞记忆潜能;
●三是重新激活免疫微环境,促进 Th1 型反应、增加 IFN‑γ 和 IL‑12 水平,从而驱动抗肿瘤免疫。
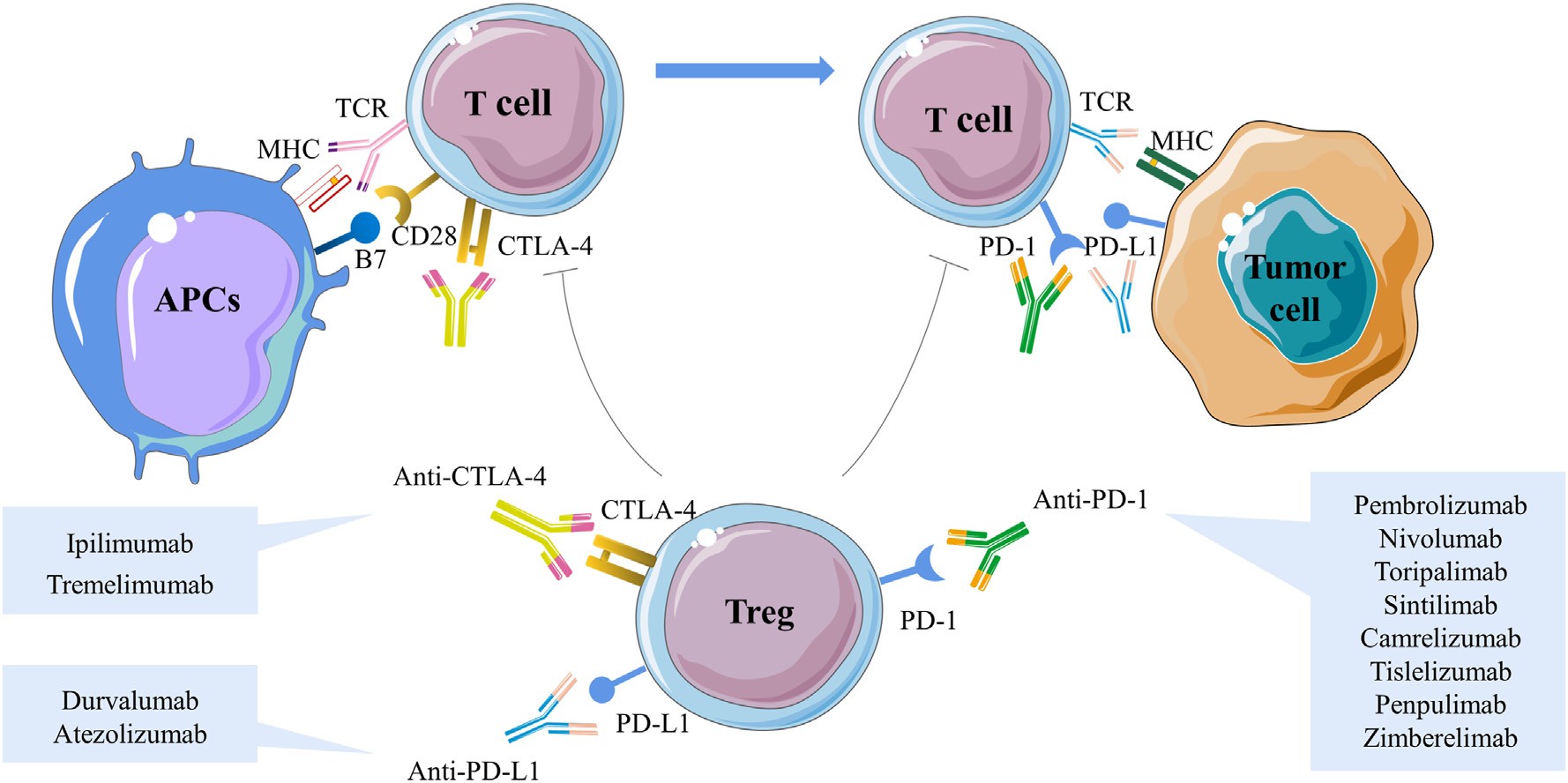
图1|免疫检查点抑制剂的作用机制
从动物模型到人体试验,FMT 的效果正在被一层层验证。在黑色素瘤中,它已被证明能“唤醒”原本耐药的患者;在肾癌、非小细胞肺癌、结直肠癌等多种癌种中,FMT 联合 PD‑1/PD‑L1 抑制剂的临床研究也在持续推进。这些研究的共同特征是:受者体内菌群多样性上升,免疫细胞活化标志物(如 CD8⁺ T 细胞、树突状细胞)增加,而抑制性细胞(Treg、MDSC)下降。与此同时,代谢组分析显示丁酸盐和次级胆汁酸上升,提示代谢通路被重构。
这类研究揭示了一种前所未有的“免疫生态互作”模式:药物在靶向分子通路的同时,FMT 提供了新的“免疫土壤”。这不仅是肠道菌群与免疫系统的跨界合作,也代表着一种癌症治疗的“共治思维”——不再单点突破,而是多系统协同。
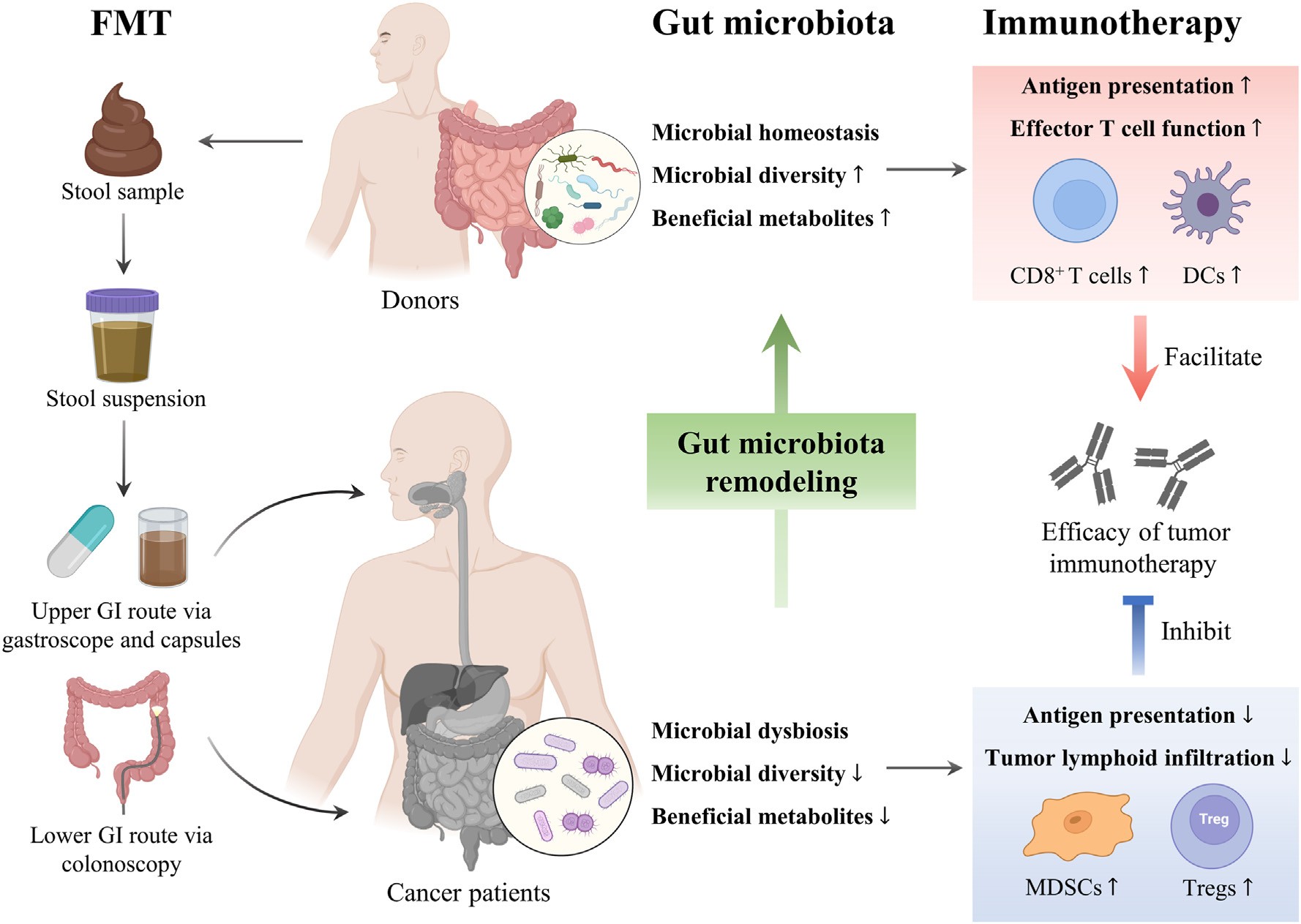
图2|粪菌移植重塑肠道菌群并增强免疫反应
然而,“登上舞台”也意味着要面对聚光灯下的质疑。FMT 毕竟是一种整体活体移植,其风险来自两端:供者和受者。论文指出,最主要的隐忧仍是感染传播与长期安全性。例如,多药耐药 E. coli 败血症、病毒与寄生虫传播等事件都提示筛查体系必须严格。此外,供者本身的代谢状态(如肥胖、糖尿病)也可能通过移植影响受者。为此,作者提出了几项实践原则:系统的供受者筛查、个体化匹配、慎用抗生素及优化移植途径(如胶囊或结肠镜联合策略),以提高“定植成功率”并降低风险。
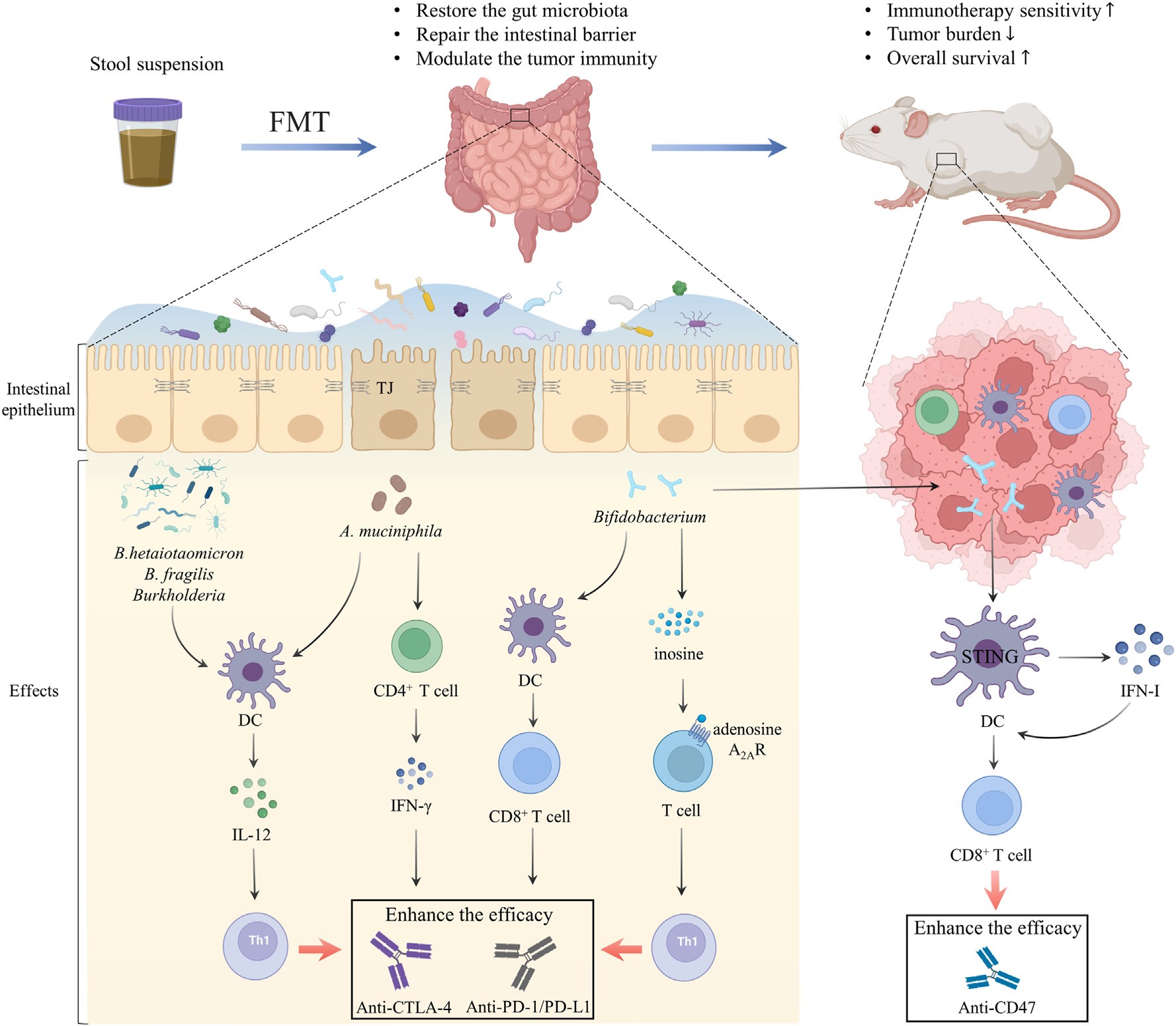
图3|粪菌移植重塑肿瘤微环境
当粪菌移植从感染治疗走向肿瘤免疫,我们见证的不仅是技术的迁移,更是医学思维的转变。过去,免疫治疗的焦点在“激活”免疫细胞;如今,我们开始关注“让免疫系统所在的生态环境重新健康”。或许未来的抗癌处方,会从药盒旁再多出一个词:microbiota。那时,医生不仅调节免疫,还要“调菌”。
参考文献
Yang Y, An Y, Dong Y, Chu Q, Wei J, Wang B, Cao H. Fecal microbiota transplantation: no longer Cinderella in tumour immunotherapy. eBioMedicine. 2024;100:104967. doi:10.1016/j.ebiom.2024.104967
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
