在癌症治疗的战场上,免疫疗法曾被视为“终极武器”——通过解除免疫系统的刹车,让身体自己识别并杀灭肿瘤。然而,在现实中,它只对部分患者奏效。为什么有的人能奇迹般缓解,而另一些人却毫无反应?答案,正越来越清晰地指向肠道。
2024 年发表在 Cell Reports Medicine 的综述指出,肠道微生物群是免疫治疗疗效的关键调控因子。研究者发现,微生物不仅影响药物代谢,更能调节抗肿瘤免疫反应,从而决定免疫检查点抑制剂(如 PD-1、CTLA-4 抗体)的成败。
在多种动物实验与临床研究中,科学家发现响应者体内往往富含 Akkermansia muciniphila、Faecalibacterium prausnitzii、Bifidobacterium longum 等菌,它们能促进抗原呈递、增强 T 细胞浸润与细胞毒性反应。而在无应答者中,Bacteroides fragilis、Fusobacterium nucleatum 等致炎菌则削弱免疫激活,甚至干扰药物作用。
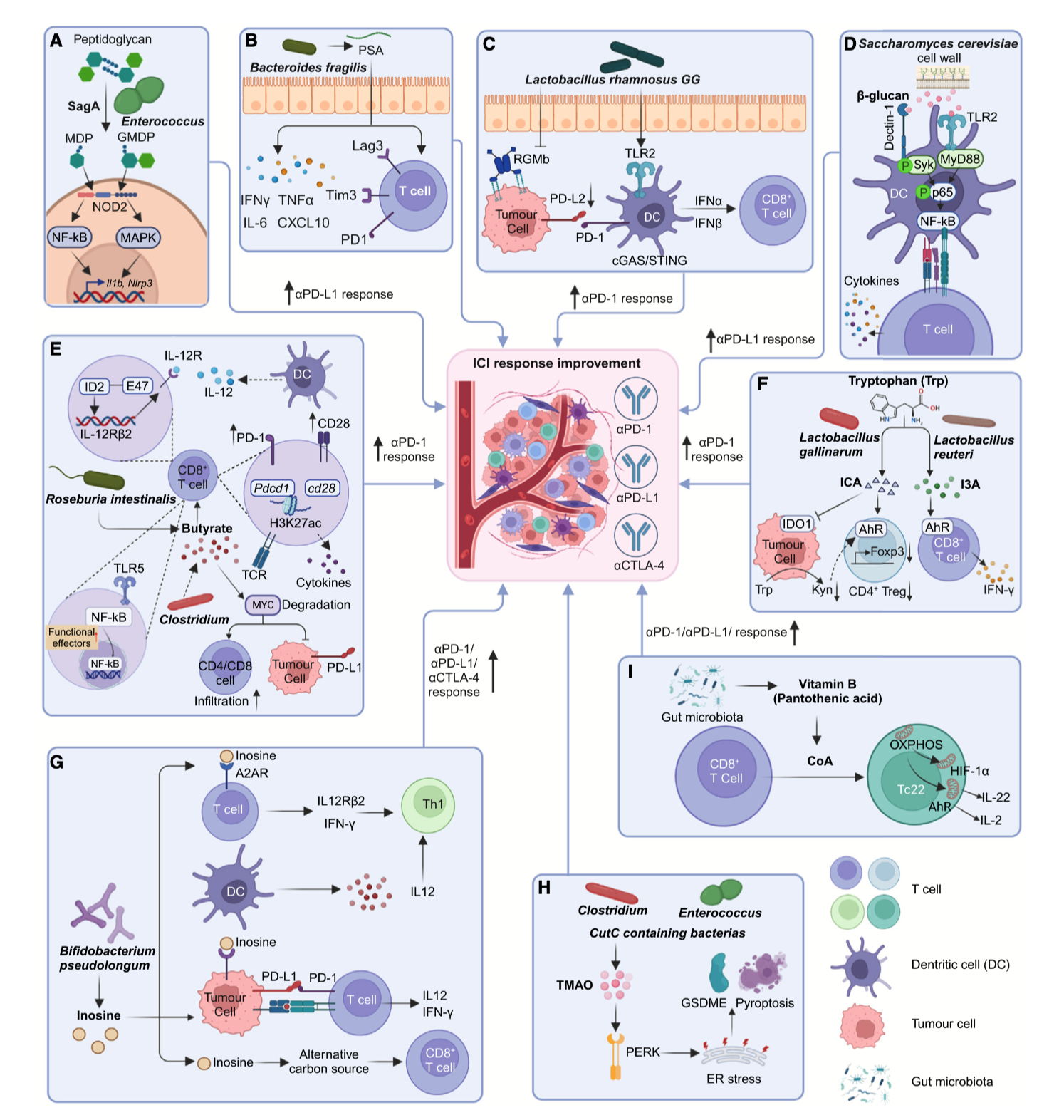
图1|肠道微生物调控免疫治疗反应的分子机制
研究者提出了多种“重新编程微生物”的干预策略。最具突破性的当属粪菌移植(FMT)。将免疫治疗响应者的菌群移植至无应答患者体内,部分病例重新获得药效。这一策略已在黑色素瘤、结直肠癌、肾癌等多项早期临床试验中显示积极信号。
相比直接移植,益生菌组合疗法提供了更安全可控的选择。科学家筛选出特定菌株,如 Lactobacillus rhamnosus GG 或 Bifidobacterium breve,它们能刺激树突状细胞成熟,促进干扰素与白介素-12 的释放,从而激活抗肿瘤免疫。此外,膳食干预(如高纤维、富多酚饮食)也被证实能增加短链脂肪酸(SCFA)生成,为免疫系统提供能量底物,提升药物敏感性。
然而,这一领域仍面临关键挑战。菌群与免疫的互动复杂且个体差异显著,同一菌株在不同宿主中可能产生相反效果。其次,粪菌移植的安全性与可重复性尚待验证。菌群组成会受饮食、药物、年龄、地理环境等多重因素影响,使标准化治疗变得困难。
因此,科学界正在迈向更“工程化”的解决方案。论文展望了未来两个方向:其一是工程菌(engineered probiotics)——通过合成生物学手段赋予益生菌新的功能,例如让 Lactobacillus reuteri 在肿瘤部位分泌免疫信号分子或抗炎肽,以局部增强免疫应答;其二是微生物外泌体(bacterial extracellular vesicles, EVs),这些纳米级“信使”可在不引入完整菌体的情况下传递有益代谢物与免疫信号,成为更安全的下一代治疗载体。
这标志着肠道微生物研究正从“相关性”迈向“可操控性”。科学家不再仅仅观察菌群变化,而是试图以药物思维“设计微生物”,将它们纳入精准医疗体系中。未来的抗癌处方,也许不仅是一支针剂,而是一套“菌群方案”——通过计算模型预测个体反应,再以工程菌或代谢物实现个性化免疫调控。
正如论文结语所言:“Harnessing microbes is no longer an aspiration—it is a therapeutic direction.” 当微生物被纳入药物研发版图,免疫治疗的疆界将不再由药物定义,而由生命共同体共同书写。
参考文献
Modulating gut microbiome in cancer immunotherapy: Harnessing microbes to enhance treatment efficacy. Cell Reports Medicine (2024).
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
