癌症免疫治疗的关键,在于能否唤醒身体自身的防御系统。但免疫系统并不总是“在线”。2023 年发表在 Science 的研究揭示,一个看似遥远的信号源——肠道菌群——正在幕后操控这场免疫觉醒。
研究团队发现,某些特定肠道菌能够驱动树突状细胞(dendritic cells, DCs)从肠道迁移至肿瘤部位,并激活强烈的 CD8⁺ T 细胞反应,从而形成一种“微生物—免疫—肿瘤”三联通路。这一发现,为理解免疫疗法的个体差异提供了新的生物学解释。
在实验中,研究者首先在小鼠模型中比较了具有不同肠道菌群的群体,结果发现仅含有特定菌株的动物能有效抑制肿瘤生长。进一步筛查确定了两种“关键战友”:Bifidobacterium pseudolongum 与 Lactobacillus johnsonii。当这两种菌被口服补充后,小鼠肿瘤中的树突状细胞数量显著增加,T 细胞浸润增强,肿瘤体积明显缩小。
这些肠道菌通过代谢产生短链脂肪酸(SCFAs)和嘌呤衍生物,激活肠道上皮细胞的模式识别受体(如 TLR 与 NOD 信号通路),从而使树突状细胞获得“迁徙许可”。随后,这些 DCs 通过淋巴循环迁移到肿瘤引流淋巴结,在那里它们呈递肿瘤抗原并激活 CD8⁺ 细胞毒性 T 细胞——免疫反应的“突击队”。
令人惊讶的是,这一过程甚至在未接受任何免疫检查点抑制剂的情况下,也能产生显著的抗肿瘤作用。而当与 PD-1 抗体联用时,疗效被进一步放大。这说明,肠道菌群不仅能“辅助”免疫治疗,更可能成为启动免疫反应的源头。
这项研究的意义不止在于揭示新机制,更在于颠覆了我们对“免疫激活”的理解。长期以来,人们认为免疫反应主要由肿瘤抗原或药物触发,而现在看来,肠道微生物在免疫网络中扮演了“司令部”的角色**。
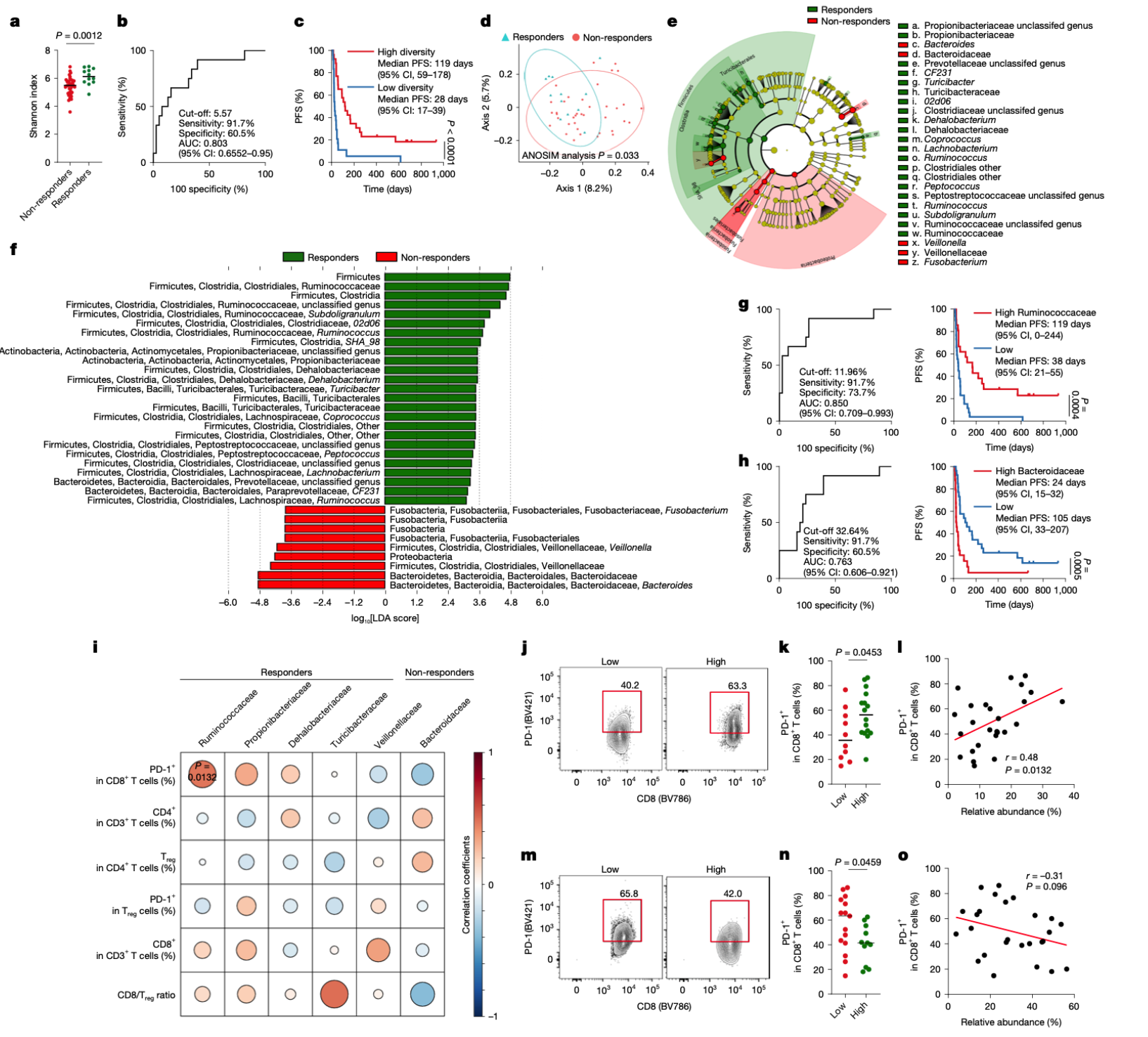
图1 | 接受PD-1免疫治疗的癌症病人,如果他们的肠道细菌种类更丰富、含有更多“瘤胃球菌科”这种有益菌,治疗往往效果更好。这可能是因为这些有益菌能帮助身体激活更多攻击肿瘤的免疫细胞(PD-1阳性的CD8+ T细胞)让免疫疗法更有威力。
不同的菌群组合,可能决定了免疫系统是否能接收到“出征信号”。这或许能解释,为什么同样的免疫疗法在不同患者间效果差异巨大。未来,如果我们能识别出最具免疫驱动力的菌株,就有望通过定向益生菌或微生物代谢物来“预热”免疫系统,让免疫治疗更高效、更个体化。
这项成果还为药物开发开辟了新思路——不仅可以靶向肿瘤,也可以靶向微生物生态。工程化菌株或代谢物递送系统,或许能成为下一代免疫调节药物。它们不直接杀死癌细胞,而是让身体自己重新学会战斗。
如作者在文末所言:“The intestine speaks to the tumour through immunity.”——肠道正在“对话”肿瘤,而科学家,终于开始听懂这种语言。
参考文献
Microbiota-driven antitumour immunity mediated by dendritic cell migration. Science (2023).doi.org/10.1038/s41586-025-09249-8
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
