在我们体内,有一种分子既属于大脑,也属于肠道——它叫 GABA(γ‑氨基丁酸)。这是一种抑制性神经递质,能让神经网络“冷静下来”。当它过少时,大脑就像被推入持续的噪音中,感知变得敏感、情绪容易泛滥。2025 年发表在 Cell Reports Medicine 的研究发现:在轻度自闭症儿童体内,这种平衡在肠道中已经被打破,而元凶是一株过度繁殖的 Escherichia(大肠杆菌)。
研究者在 128 名儿童样本中发现,轻度自闭症谱系障碍(ASD)患者的肠道代谢图谱呈现出鲜明特征:GABA 及其前体谷氨酸(Glu)的比例失衡,代谢方向明显偏向兴奋性通路。这一发现意味着,行为的根源,可能从神经突触延伸到了肠道菌群的代谢网络中。
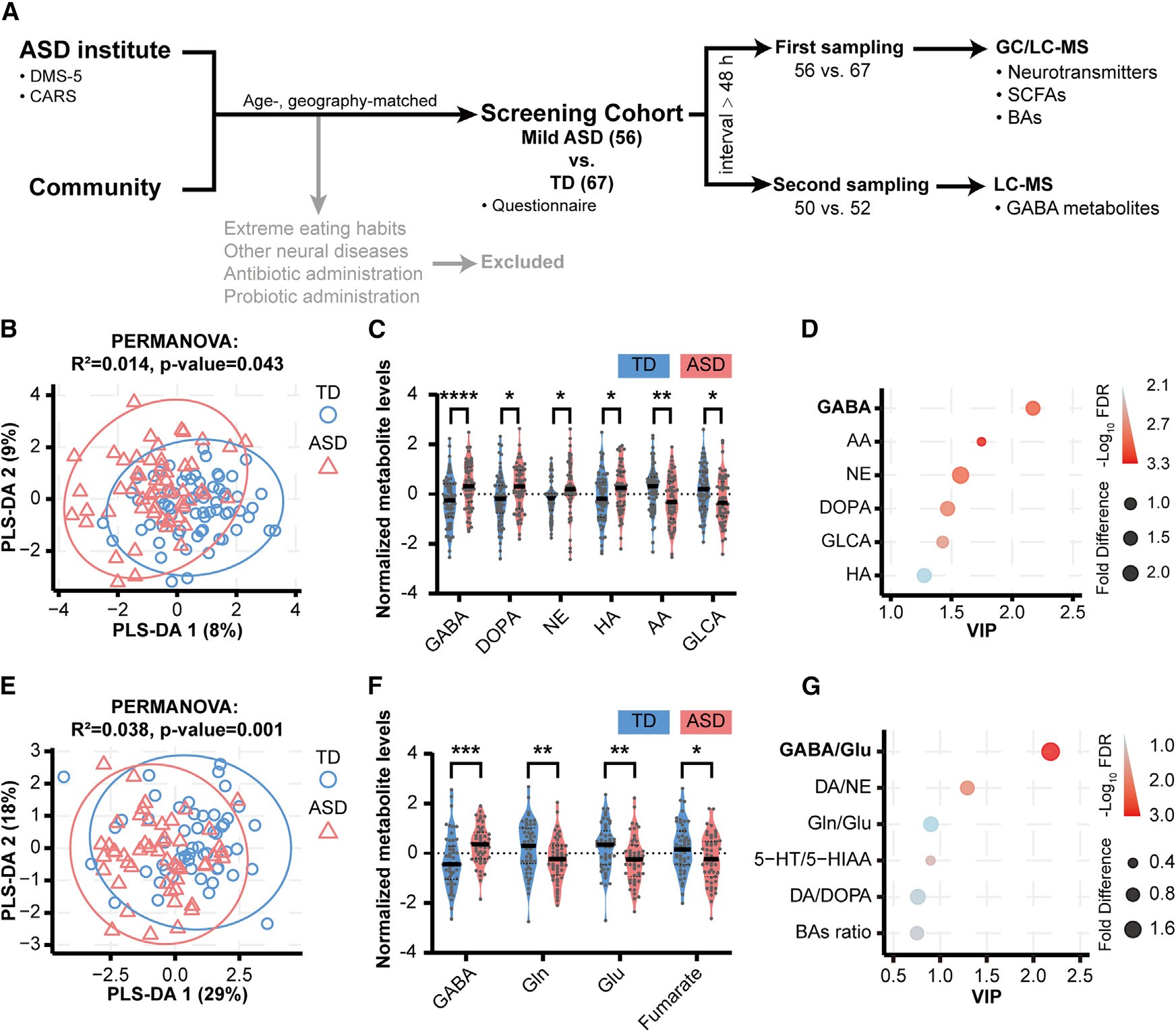
图1|肠道中 GABA 与谷氨酸代谢失衡,是自闭症的年龄与性别无关特征。
这种代谢异常并非孤立现象。研究团队通过宏基因组分析发现,在自闭症儿童肠道中,GABA/Glu 比值的升高伴随着菌群结构的失衡——尤其是 Escherichia 属的显著富集。它们携带着谷氨酸脱羧酶(GAD)相关基因,但缺乏 GABA 转运系统,意味着它们能高效“吞噬”谷氨酸,却几乎不释放 GABA,从而打破整个生态的抑制‑兴奋平衡。
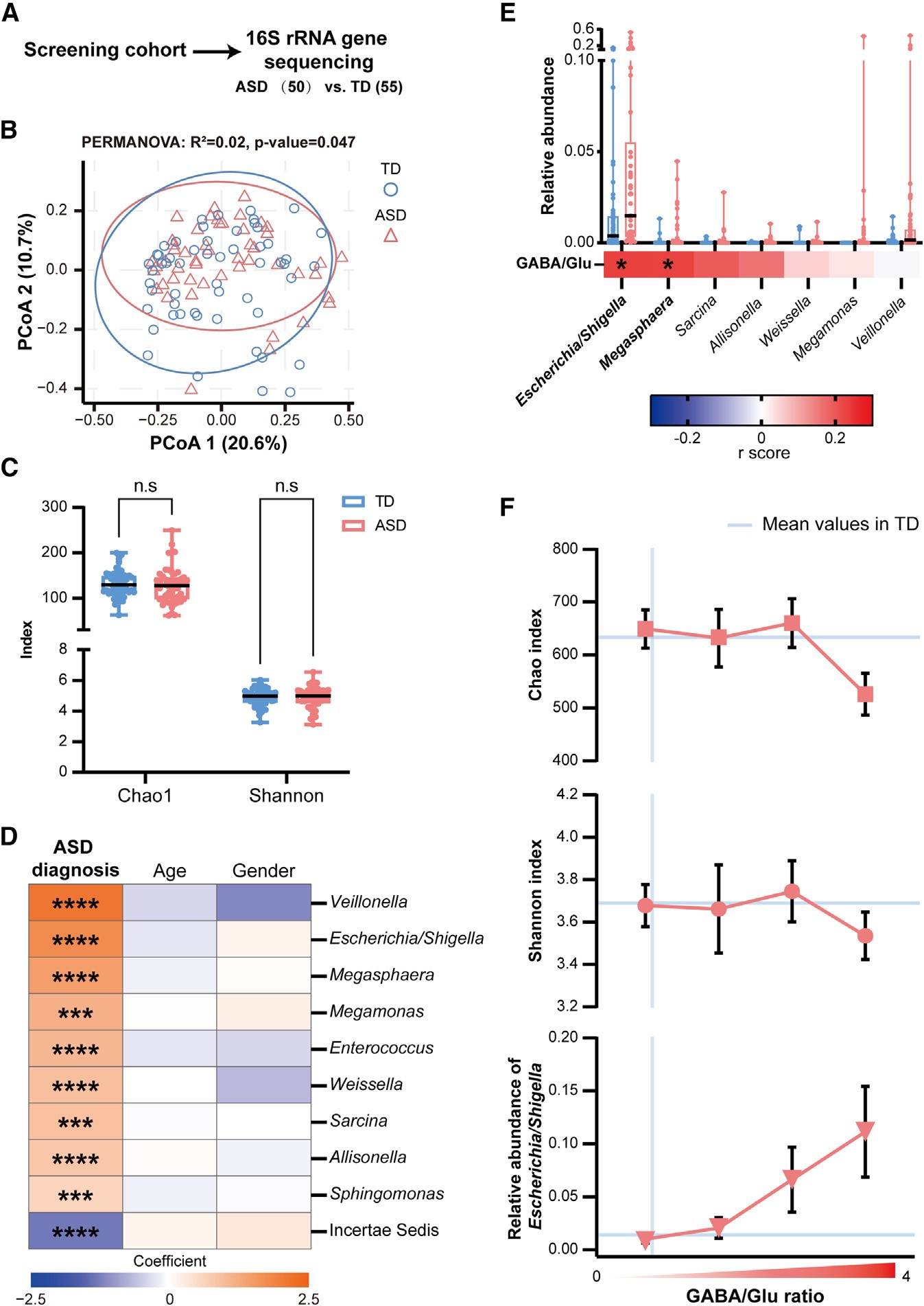
图2|GABA/Glu 比值升高与自闭症肠道菌群结构失衡密切相关。
当研究者将这些 Escherichia 菌株移植到无菌小鼠体内,短短三周后,小鼠的肠道 GABA 水平显著下降,大脑前额叶皮层的 GABA 受体信号同步减弱。动物表现出类似自闭症的行为——社交探索减少、声音刺激下焦虑增强。相反,抑制这些菌株的生长或补充能释放 GABA 的 Bacteroides fragilis,都能让行为恢复正常。
这一结果揭示,肠道菌群的代谢活动足以改变神经信号传导,从而塑造社交与情绪模式。
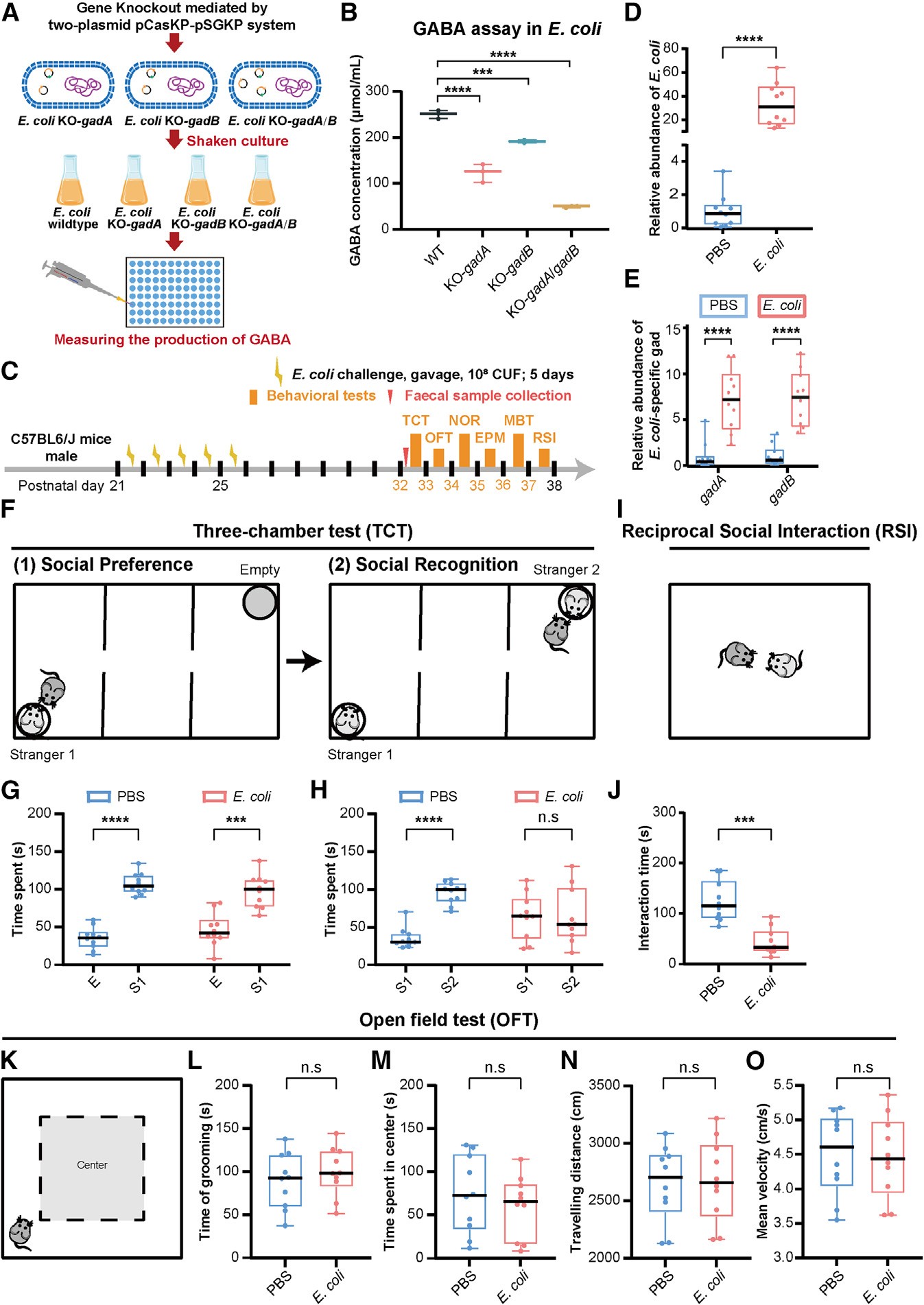
图3|在肠道中增加 E. coli 挑战,会导致小鼠出现社交障碍。
Figure 5. Challenge of E. coli in the gut leads to social deficiencies in mice
这项研究的意义不仅在于发现“哪种菌出了问题”,而在于揭示“行为”背后的代谢逻辑。我们以往以为,GABA 的平衡完全由大脑神经元控制,但现在知道,它的源头在肠道——超过九成的 GABA 是在肠道中合成的。肠道菌群通过代谢产物、免疫信号、以及迷走神经通路,影响着大脑的抑制‑兴奋比。这种跨系统的“代谢对话”,使得微生物成为调节情绪与社交能力的无形推手。
更令人深思的是,这种代谢失衡主要出现在“轻度自闭症”群体中。重度患者的菌群更复杂,信号被多重通路掩盖。换言之,微生物异常也许是疾病早期的代谢标志,而非晚期结果。这为早期干预提供了全新的线索——或许在行为症状出现之前,肠道已经在发出化学预警。
值得注意的是,Escherichia 并非外来病原体,而是我们最熟悉的共生菌之一。它们在多数人身上安静共处,但在某些个体中,却因环境、饮食或免疫状态而被“推上风口”。当它们占据主导,代谢通路失衡,肠道的抑制‑兴奋比也随之崩塌。
这种细微的生态漂移,或许就是行为变化的化学起点。
这项研究并未宣称“肠杆菌导致自闭症”,而是为我们提供了一个全新的理解框架:自闭症并非单一器官的疾病,而是一场跨越大脑与肠道的代谢失衡。它提醒我们,大脑的宁静,也许始于肠道的安稳。未来的干预手段,可能不止是神经药物,而是重新设计微生物共生网络,让失衡的信号重新回归和谐。
参考文献
Li Y, et al. Gut microbial GABA imbalance emerges as a metabolic signature in mild autism spectrum disorder linked to overrepresented Escherichia. Cell Reports Medicine. 2025;6(4):101234. doi:10.1016/j.xcrm.2025.101234.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
