我们常常以为,行为问题的根源藏在大脑里。无论是社交退缩,还是注意力过度活跃,都被认为是基因突变扰乱了神经发育的结果。但 2021 年发表在 Cell 的一项研究提醒我们:故事也许没那么简单。科学家们通过对同一基因突变小鼠的深入分析发现,有的行为确实源于基因,但有的却来自肠道微生物的“干预”。
他们使用的是一种经典的自闭症模型小鼠——Cntnap2−/−。这类小鼠因基因突变表现出社交障碍和过度活动两种主要行为。研究者做了一个简单却关键的实验:重新设计这些小鼠的繁育方式。结果出人意料——社交障碍竟然会随着肠道菌群的交换而消失,而多动症状却稳如磐石。这意味着,社交障碍是“可传递”的,而多动是写在基因里的。
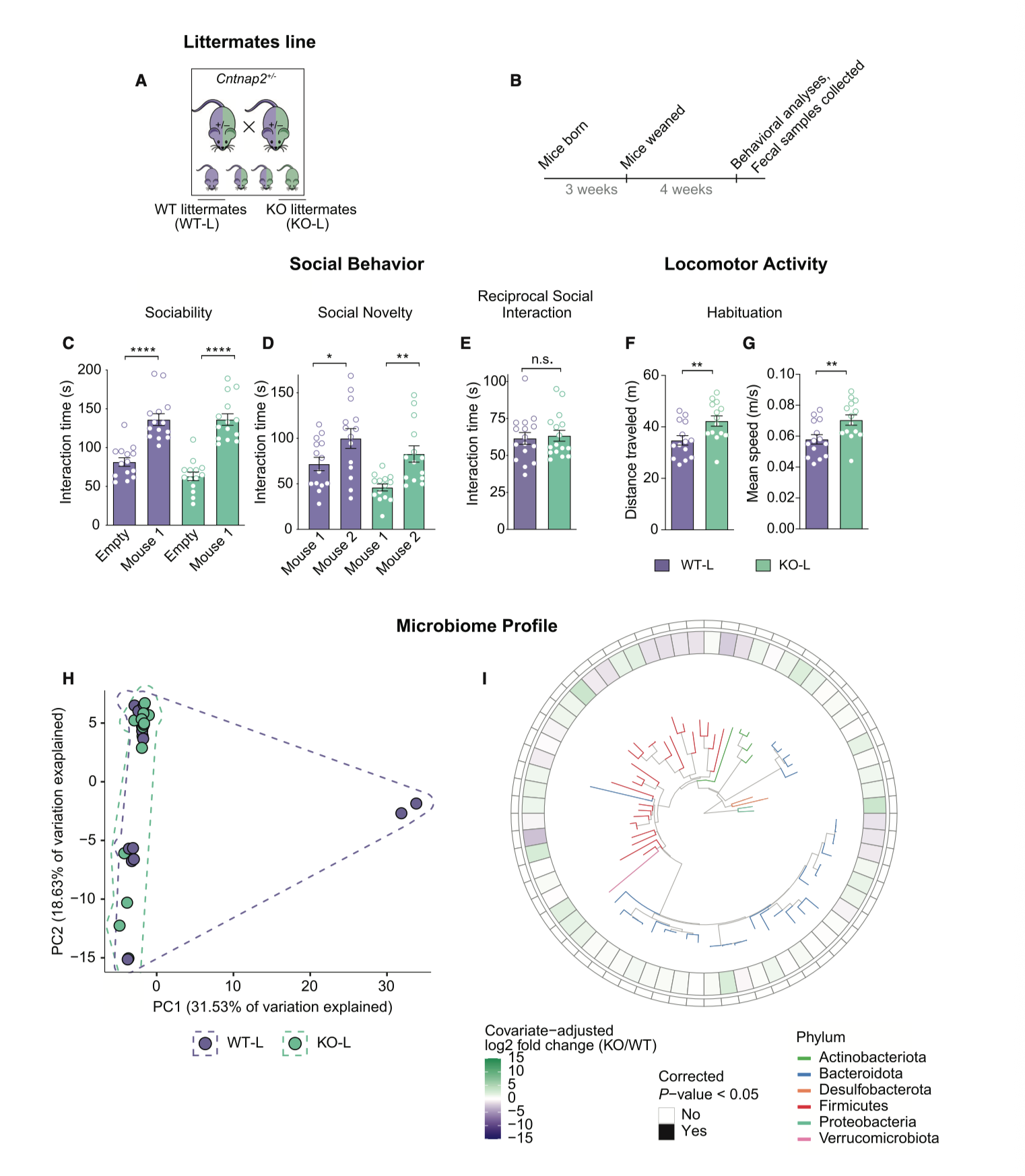
图1|孤立繁育的 Cntnap2−/− 小鼠表现出社交缺陷、过度活动及独特的菌群结构。
在孤立繁育环境下成长的突变小鼠(KO-I)几乎不愿与同类互动,它们回避气味、减少嗅探、甚至在社交实验中“游离”在角落。而当这些小鼠与正常同窝个体共同成长(KO-L)时,情况完全不同——社交恢复了,行为接近健康水平。研究者用 16S 测序发现,两组小鼠的肠道菌群差异显著,KO-L 的微生物结构几乎与野生型一致。换句话说,社交障碍的“拯救者”并非药物,而是同伴的肠道菌群。
于是科学家进一步进行了合笼、分居和粪菌移植实验。结果一再重复:社交行为的好转伴随着菌群的改变,而活动度则始终与基因型紧密挂钩。
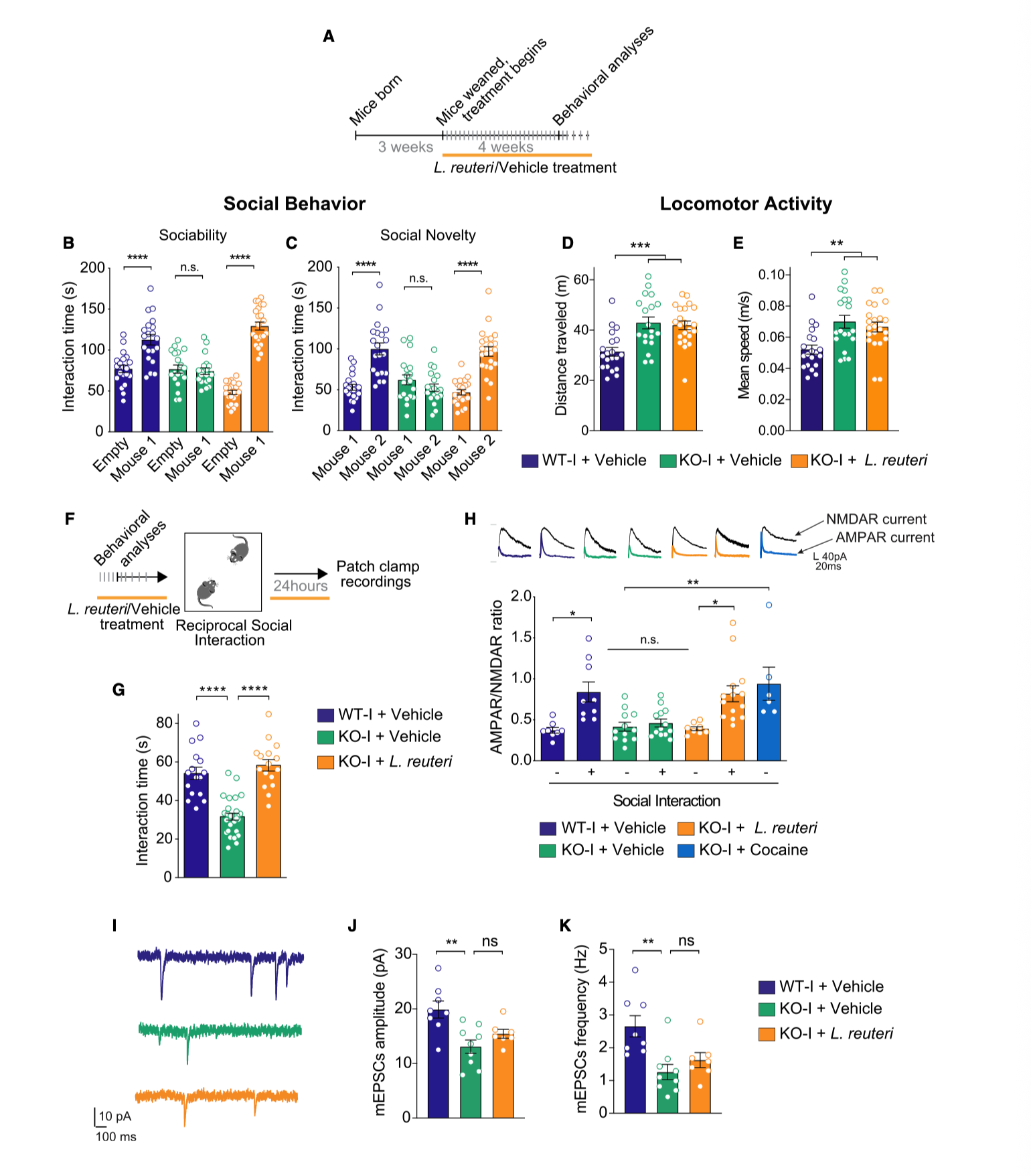
图2|粪菌移植实验表明,社交行为可被菌群“传递”,但多动表型不受影响
这场“菌群接力”让研究者确信:基因和肠道菌群共同塑造着复杂行为。前者设定结构,后者调节气氛。就像同一个剧本,不同导演可以拍出不同版本。基因决定了角色设定,而微生物群落则能改写剧情的细节。
那么,肠道菌群是如何影响大脑的?研究者找到了一个线索——一株在以往研究中与社交行为密切相关的益生菌 Lactobacillus reuteri。当他们给突变小鼠口服这一菌株后,社交能力被显著恢复,但多动毫无改变。显然,这种“选择性救援”不是巧合。进一步的脑电记录表明,L. reuteri 恢复了与社交奖赏相关的神经环路——中脑腹侧被盖区(VTA)的突触可塑性。那是让我们感受到“社交愉悦”的核心区域。
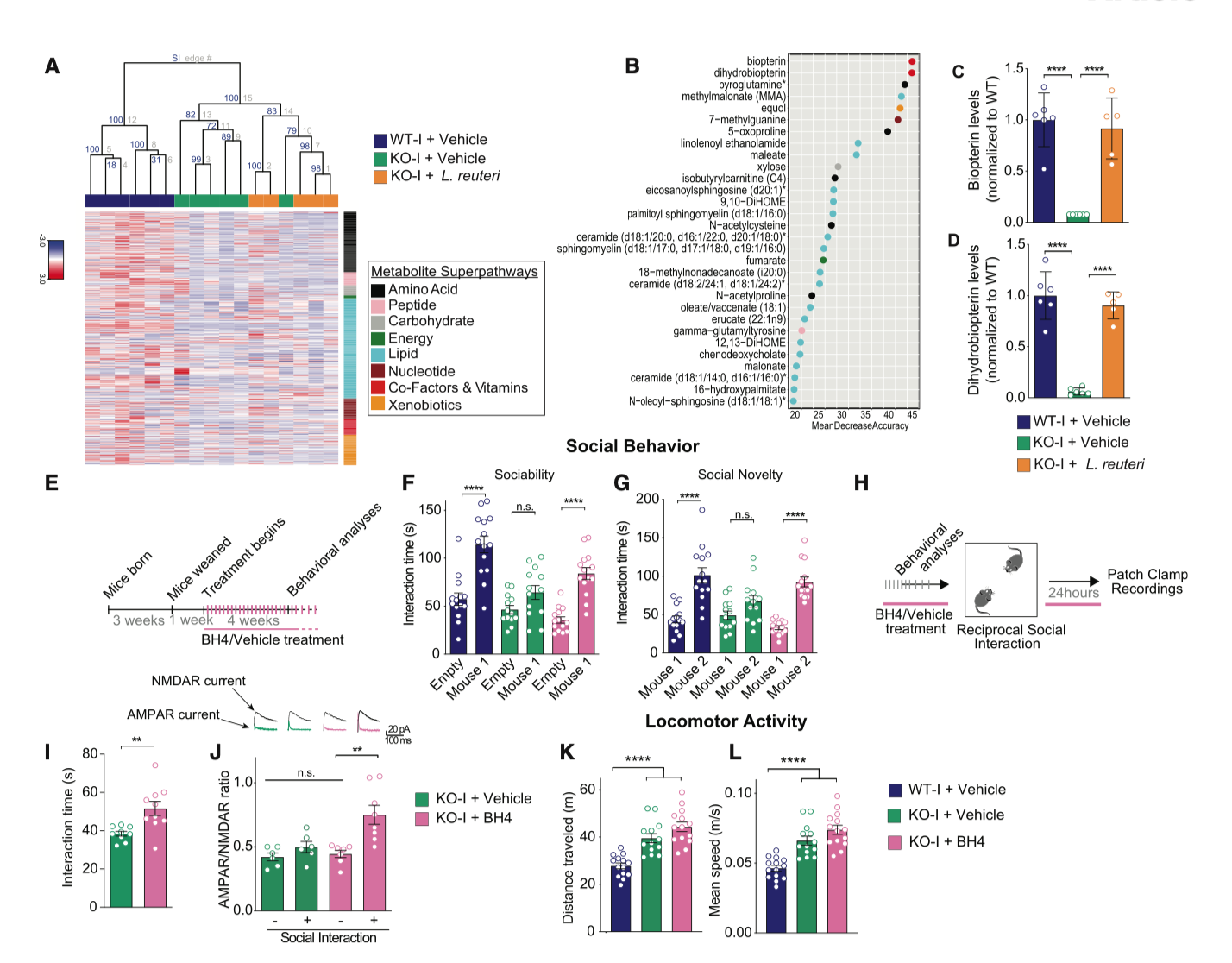
图3|L. reuteri 增强 BH4(四氢生物蝶呤)合成通路,恢复社交行为但不影响多动
更深层的机制来自代谢组学分析:L. reuteri 的作用依赖于一种名为 BH4(四氢生物蝶呤)的代谢通路。BH4 是合成多巴胺和血清素等神经递质的关键辅因子。孤立系突变小鼠的 BH4 含量显著下降,而益生菌干预后恢复至正常水平。直接补充 BH4 也能带来同样的社交改善,而抑制这一通路则会让益生菌失效。这表明,肠道微生物通过代谢信号介入神经发育,用分子语言“调音”了行为。
这一发现让“肠–脑轴”从假说变得更加立体。社交行为的异常不只是神经网络的错,也可能是体内生态系统的失衡。微生物通过代谢物、免疫调节和神经通路参与行为塑形,构成了基因之外的第二层“行为基因组”。而多动这种高能量输出型行为,则牢牢锁定在宿主基因控制之下。基因和菌群,共同书写了复杂行为的两个章节:一个是主旋律,另一个是变奏。
从更宏观的角度看,这项研究还提醒我们:科学中的“因果”从来不止一条线。以往我们把遗传突变视为终点,而现在我们看到,突变的效应需要在一个微生物世界中才能被真正表达。肠道菌群像一个放大器,让某些行为信号变得更强,也让另一些沉寂下去。
未来的行为生物学可能不再局限于基因编辑或神经调控,而是进入一个新的维度——通过重塑肠道生态,重新定义行为模式。也许有一天,针对自闭症或情绪障碍的治疗,不仅会有神经递质类药物,还会有“定制化微生物处方”。
参考文献
Buffington SA, Dooling SW, et al. Dissecting the contribution of host genetics and the microbiome in complex behaviors. Cell. 2021;184(7):1760–1775.e17. doi:10.1016/j.cell.2021.02.009.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
