在自闭症谱系障碍(ASD)的药物研发里,最大困境是“看得见的症状,摸不着的靶点”。这项发表于 Nature Medicine 的开放标签一期b/二期a临床试验,选择了一条颇具颠覆性的路径:不直接作用于大脑,而是在肠道里用一种“分子海绵”——AB‑2004(亦称 AST‑120)去吸附一组与行为相关的微生物来源小分子(如 4‑ethylphenyl sulfate,4EPS;p‑cresol sulfate,pCS;3‑indoxyl sulfate,3IS 等),看看能否在不进入血液的前提下,影响机体的代谢与行为。研究对象为 30 名伴有胃肠道症状的 ASD 青少年(12–17 岁),在新西兰与澳大利亚三家中心入组;核心目的为评估安全性与可耐受性,并以血尿代谢物变化验证靶点参与(target engagement)。
动物实验先行铺路。研究团队在无菌小鼠中引入可产生 4EP/4EPS 的肠道菌组合,证实 AB‑2004 可显著降低尿中 4EPS,并改善开放场与高架十字迷宫中的焦虑样行为;这为“先清掉小分子,再观察行为”提供了因果链条的模型依据。
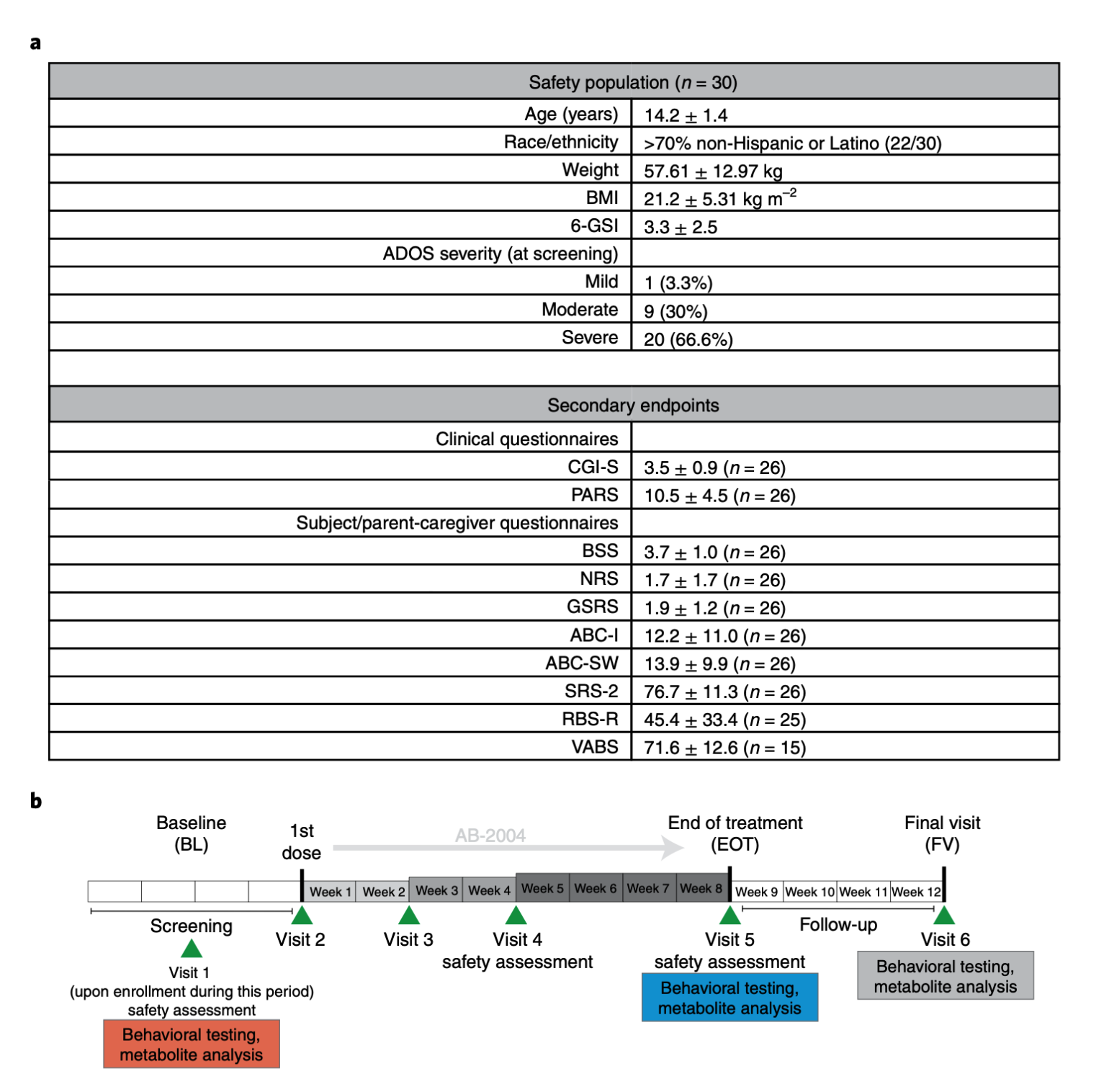
图1|受试者特征与试验时间线
临床部分采用体重分层的三阶段递增给药,每日分三次,总量从 ≤2.25 g/日,2 周后升至 ≤4.5 g/日,再在第 4–8 周升至 ≤6 g/日;治疗 8 周,停药 4 周随访。期间收集血、尿、粪样本,并在基线(BL)、治疗结束(EOT)与随访(FV)进行多维度量表评估(如 PARS 焦虑、ABC‑I 易激惹、SRS 社交、VABS 适应性行为等)。完成 EOT 的有 27 人,完成 FV 的 24 人;依从性中位数 97.5%。最关键的是,未出现药物相关的严重不良事件,多数不良反应为轻中度胃肠道不适(腹痛、恶心等),总体安全性良好。
更具解释力的是“靶点参与”证据。相较基线,AB‑2004 在 8 周时让多种肠源性酚类/吲哚类代谢物在尿液(并在血浆中呈相似趋势)显著下降:包括 4EPS、pCG、pCS、3IS、HPHPA、HPAA 等;停药 4 周后大多回到接近基线,提示下降与药物吸附有关,而非饮食或其他偶然因素的长期改变。与此同时,用作阴性对照、理论上不被 AB‑2004 结合的 N‑acetyl‑serine 未见变化,进一步支撑了特异性。
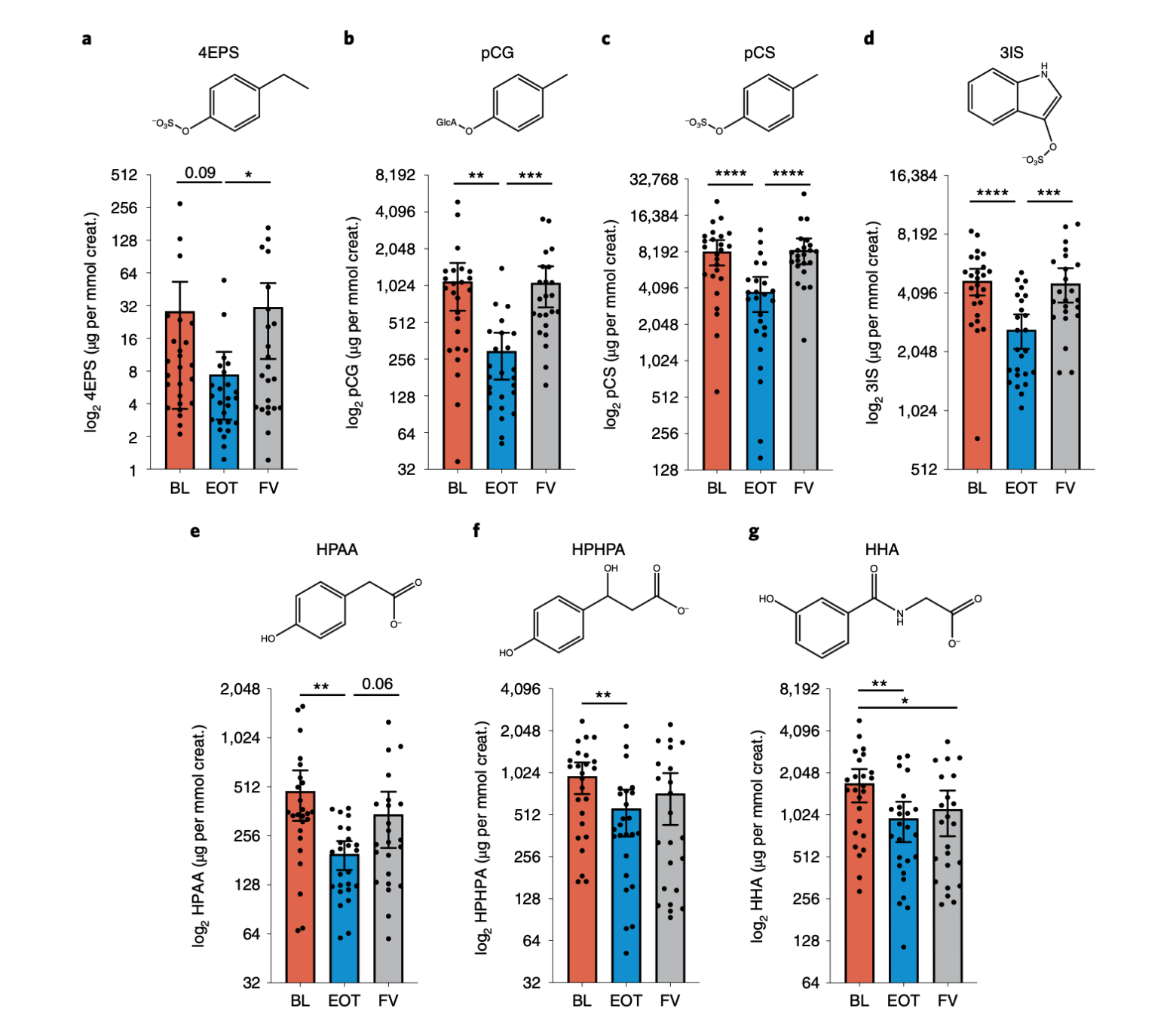
图2|AB‑2004 降低多种微生物来源代谢物
行为端点作为探索性观察,也出现了有价值的信号:
●在基线焦虑较高(PARS≥10)的 15 名受试者里,PARS 平均下降约 30%,且部分改善在停药后仍可见;
●在基线易激惹较高(ABC‑I≥15)的亚组中,ABC‑I 平均降低 9.1 分,停药后改善部分回退;
●适应性行为(VABS)的综合分、沟通与社交分数在治疗期也有统计学提升;
●10 名受试者的静息态 fMRI 显示杏仁核与前扣带回(rACC)之间的功能连接下降——这与焦虑水平降低的方向一致。
需要强调的是,这是一项无对照、样本量小、多端点的早期研究。开放标签设计意味着安慰剂效应不可避免,统计分析多为事后(post hoc)解读;因此,这里呈现的是“值得继续做随机对照试验”的方向性证据,而非确证疗效的结论。研究团队也据此开展了后续的双盲随机对照研究,以验证“减少肠源小分子暴露→缓解焦虑/易激惹等症状”的可重复性与效应量。
这项工作真正的意义,在于把可干预的“环境”因子具体化:不是泛泛而谈“肠道菌群”,而是定位到一组结构相关的小分子;不是依赖全身给药穿越血脑屏障,而是用胃肠道限制型吸附剂在“源头”做拦截。对家长与临床一线而言,短期内我们还不能把它视作“核心症状药物”,但它提供了一条风险较低、机制清晰、与行为相关性可监测的干预路径:既可通过代谢物谱监控“药打到了哪”,也能在行为量表与影像学上寻找一致的改善线索。
如果把 ASD 的复杂性比作“多齿轮联动”,基因是齿轮的基础纹路,微生物与代谢物则像润滑或阻滞其中的一层介质。AB‑2004 的早期数据告诉我们:当这层介质被改变,部分齿轮的运行确实会更顺一点。下一步,就看在严格的对照条件下,这种“顺”能否稳、能有多大,以及对哪些孩子最有效。
参考文献
Campbell AS, Needham BD, Meyer CR, et al. Safety and target engagement of an oral small‑molecule sequestrant in adolescents with autism spectrum disorder: an open‑label phase 1b/2a trial. Nature Medicine. 2022;28:528–534. doi:10.1038/s41591-022-01683-9
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
