我们常说“肠道是第二大脑”,但对科学家来说,这不仅是一种比喻。越来越多的研究表明,肠道菌群与大脑之间通过代谢、免疫和神经信号保持着持续的双向交流。而在自闭症谱系障碍(ASD)儿童中,这条“肠–脑通路”似乎尤为重要。2025 年发表于 Translational Psychiatry 的一项研究首次在人类儿童中同时描绘出两张地图——一张是肠道微生物的结构图,另一张是大脑白质的微观连线图——并发现它们之间竟然存在精确的镜像关系。
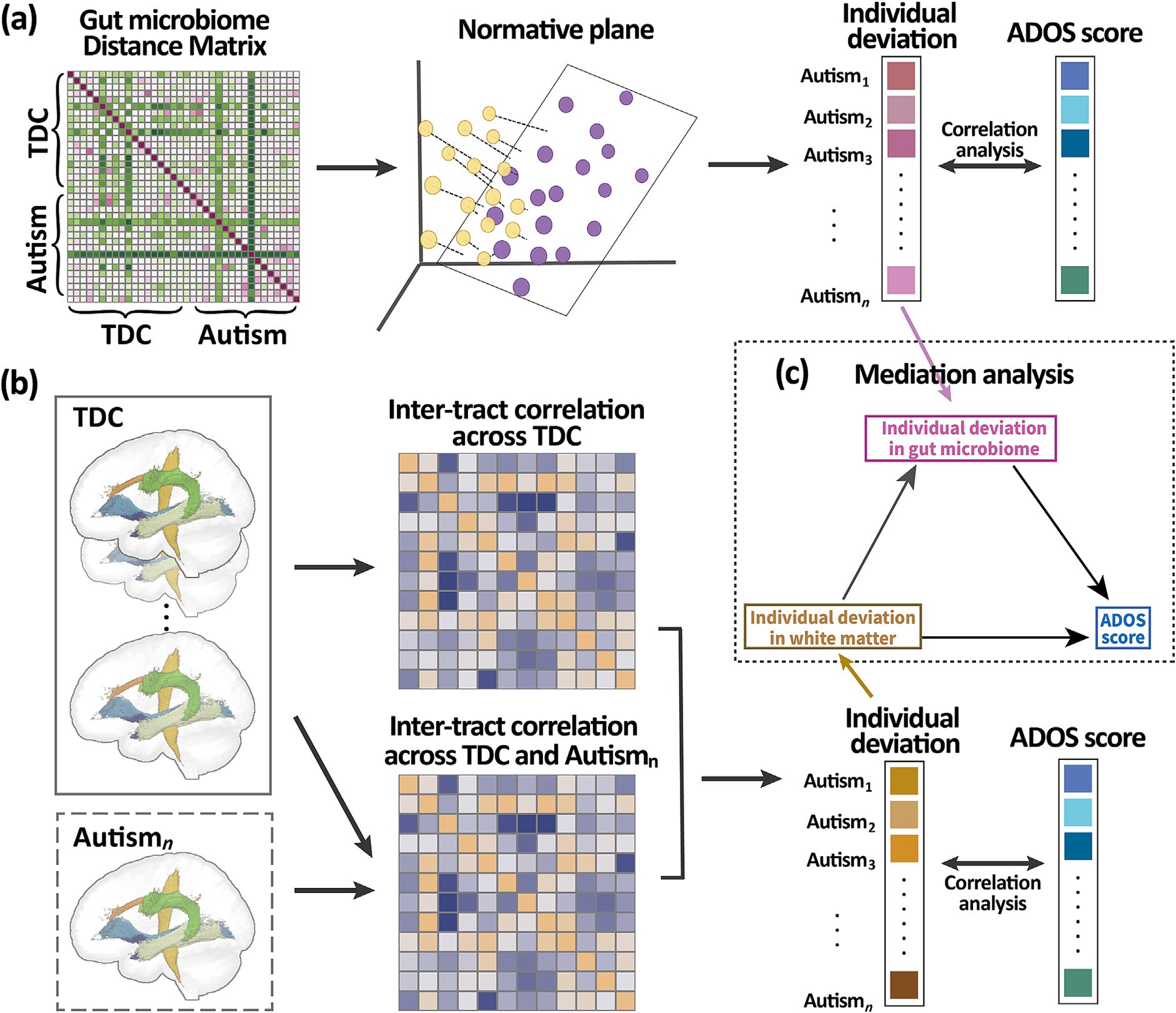
图1|数据分析流程示意图。展示了肠道菌群偏离分析、白质微结构偏离计算及中介效应建模。
研究团队收集了 112 名 3–7 岁自闭症儿童的粪便样本与磁共振扩散张量成像(DTI)数据,用以刻画个体肠道菌群组成与大脑白质微结构的“偏离度”。所谓偏离度,指的是相较于同龄典型发育儿童的差异强度——偏离越大,意味着该系统的发育轨迹越异常。
结果显示,这两张地图并非独立存在。肠道菌群的个体偏离与大脑白质结构偏离呈显著正相关,而二者共同预测了儿童的社交功能分数(ADOS 评分)。也就是说,一个孩子的菌群越“异化”,其白质连接也越异常,社交得分越低。这是首次在儿童层面直接验证“肠–脑结构协变”与社交障碍的关联。
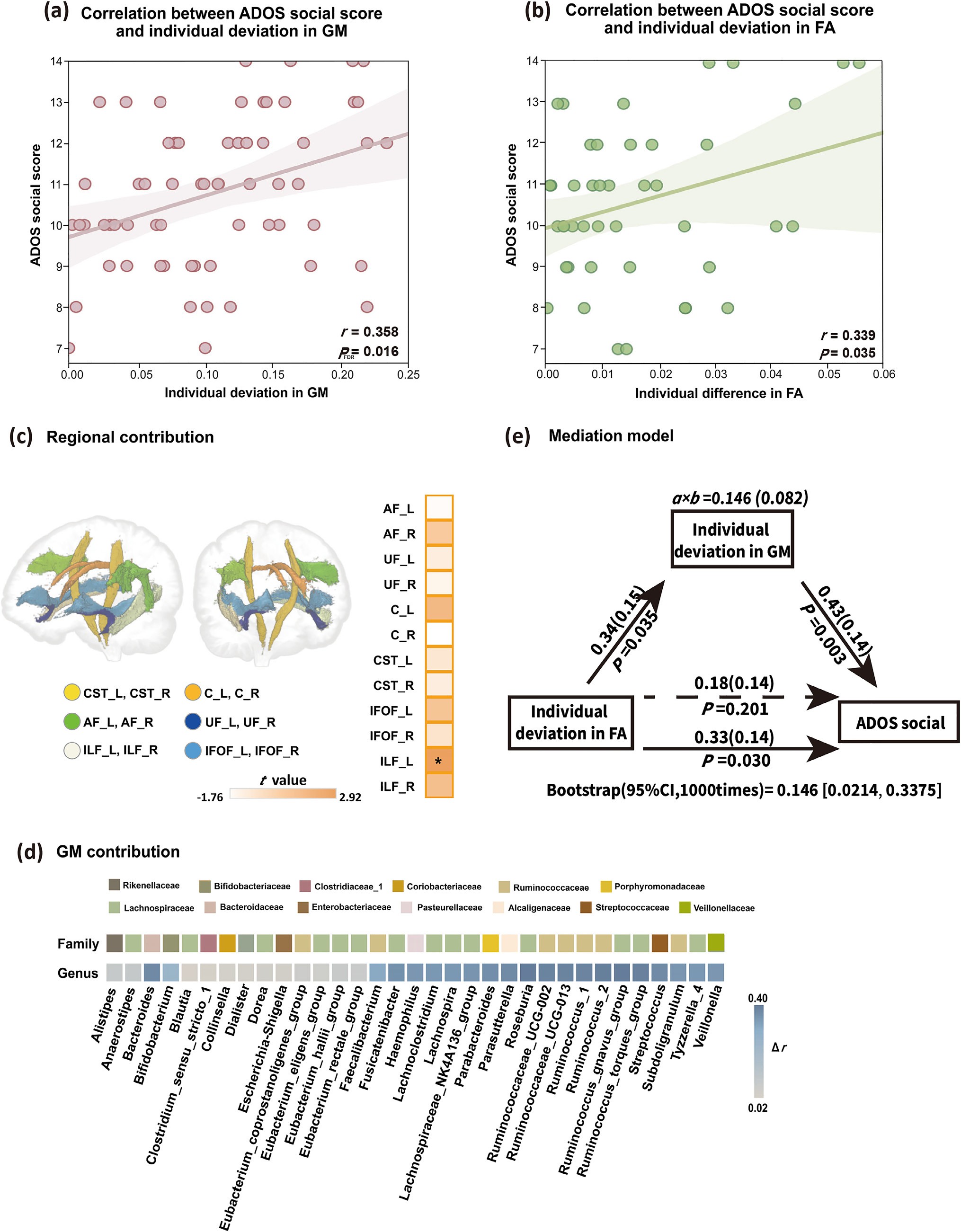
图2|肠道菌群偏离与白质微结构偏离均与社交得分显著相关,肠道菌群在二者关系中起中介作用。
更令人惊讶的是,当研究者建立中介模型后发现,肠道菌群在“白质结构 → 社交行为”的通路中起到了桥梁作用。这意味着,脑白质的发育异常可能通过肠道菌群的改变,进一步影响社交功能。具体而言,白质纤维束的偏离会导致神经活动节律改变,从而影响肠神经系统与肠道微生物的生态稳定;反之,微生物代谢产物的变化又会通过迷走神经与免疫信号反作用于中枢神经发育,形成闭环。
这条“肠–脑–行为”路径的中介机制,让我们第一次有机会在儿童层面理解社交障碍背后的多系统耦合。
在结构层面,研究团队发现前额叶–扣带束(cingulum bundle)与岛叶–壳核通路的偏离最显著,这些区域正是与情绪共鸣与社交动机相关的神经网络。而在菌群层面,Lachnospiraceae 与 Ruminococcaceae 家族的丰度变化最为关键,它们与短链脂肪酸(SCFA)的生成密切相关,后者被认为能调节脑内胶质细胞发育与突触形成。换句话说,一个孩子的社交大脑,也许部分由肠道代谢塑造。
研究还发现,菌群的个体差异远大于群体差异,这提示“自闭症的肠道特征”并非统一模板,而是个体化生态谱。这也解释了为何肠道干预在临床上效果不一:每个孩子的肠道都在讲述不同的发育故事。未来的精准治疗,可能需要整合神经影像、生化代谢与微生物学的多维信息,才能真正“对号入座”。
这项研究让我们重新理解“社交障碍”这一概念——它不只是神经元的事,也关乎微生物、代谢物、乃至整个身体的共振。肠道与大脑之间,不再是一条单向的神经线,而是一张双向互动的网络。
当我们谈论社交的缺失时,也许该倾听一下来自肠道的低语。
参考文献
Zhang H, et al. Linking gut microbiome profiles and white matter integrity to social behavior in young autistic children: from the perspective of individual variation. Translational Psychiatry. 2025;15(1):102. doi:10.1038/s41398-025-02891-0.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
