长期以来,自闭症(ASD)被视为一种典型的神经发育障碍:沉默、刻板、社交退缩似乎都源于大脑的异常。
但新的研究正在颠覆这种认知。越来越多证据表明,自闭症的某些症状,或许不是“心理问题”,而是“微生物失衡”在身体里的回声。
2020年发表在 Microbiome 的一项临床研究中,科学家首次在人类中验证:通过益生元(prebiotic)干预,可以改变自闭症儿童的肠道菌群与代谢状态,并改善社交行为。
研究团队来自英国雷丁大学,招募了30名2–11岁的儿童,其中一半患有ASD。
所有孩子被随机分配服用含半乳寡糖(B-GOS®)的益生元或安慰剂,干预持续6周;部分受试者同时遵循无麸质、无酪蛋白(GFCF)饮食。
研究者希望通过这种“双重干预”,观察肠道菌群、短链脂肪酸(SCFA)及行为的变化。
结果非常引人注目。
在肠道层面,益生元显著提高了双歧杆菌(Bifidobacterium longum)与 Lachnospiraceae 家族的丰度,降低了潜在的致炎菌如 Clostridium。
在代谢层面,乙酸和丙酸浓度升高,提示肠道发酵功能活跃,能量代谢更加平衡。
而最关键的是——在接受排除饮食的ASD儿童中,社交反应能力显著改善,情绪波动减轻,SRS(社交反应量表)评分下降。
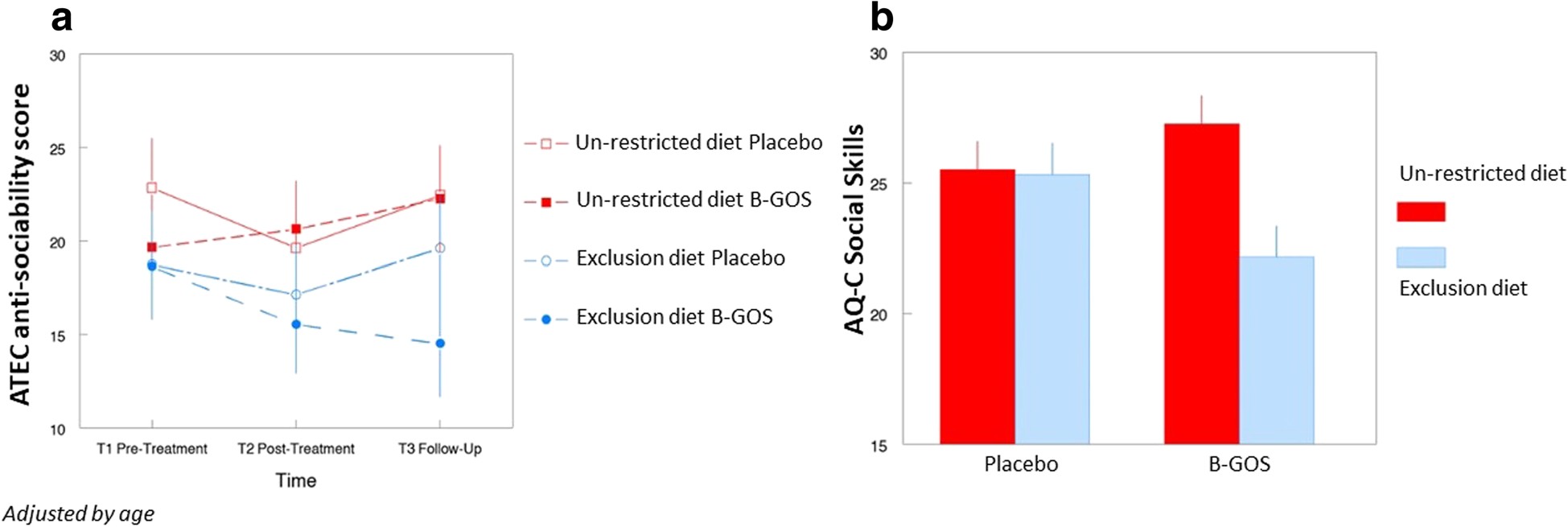
图1 益生元促进双歧杆菌上升,并改善社交行为评分。
这些结果让研究者提出了一个大胆假说:
肠道菌群可能通过代谢信号,影响神经发育与情绪调节。
在自闭症儿童体内,肠道屏障功能受损、发酵产物不足,导致毒素与炎症因子进入循环,引起神经炎症与神经递质失衡。
而益生元则通过喂养有益菌、促进短链脂肪酸(尤其是丁酸)生成,从而强化肠屏障、调节免疫反应,并刺激肠–脑轴的神经信号(如5‑HT、GABA、GLP‑1等)。
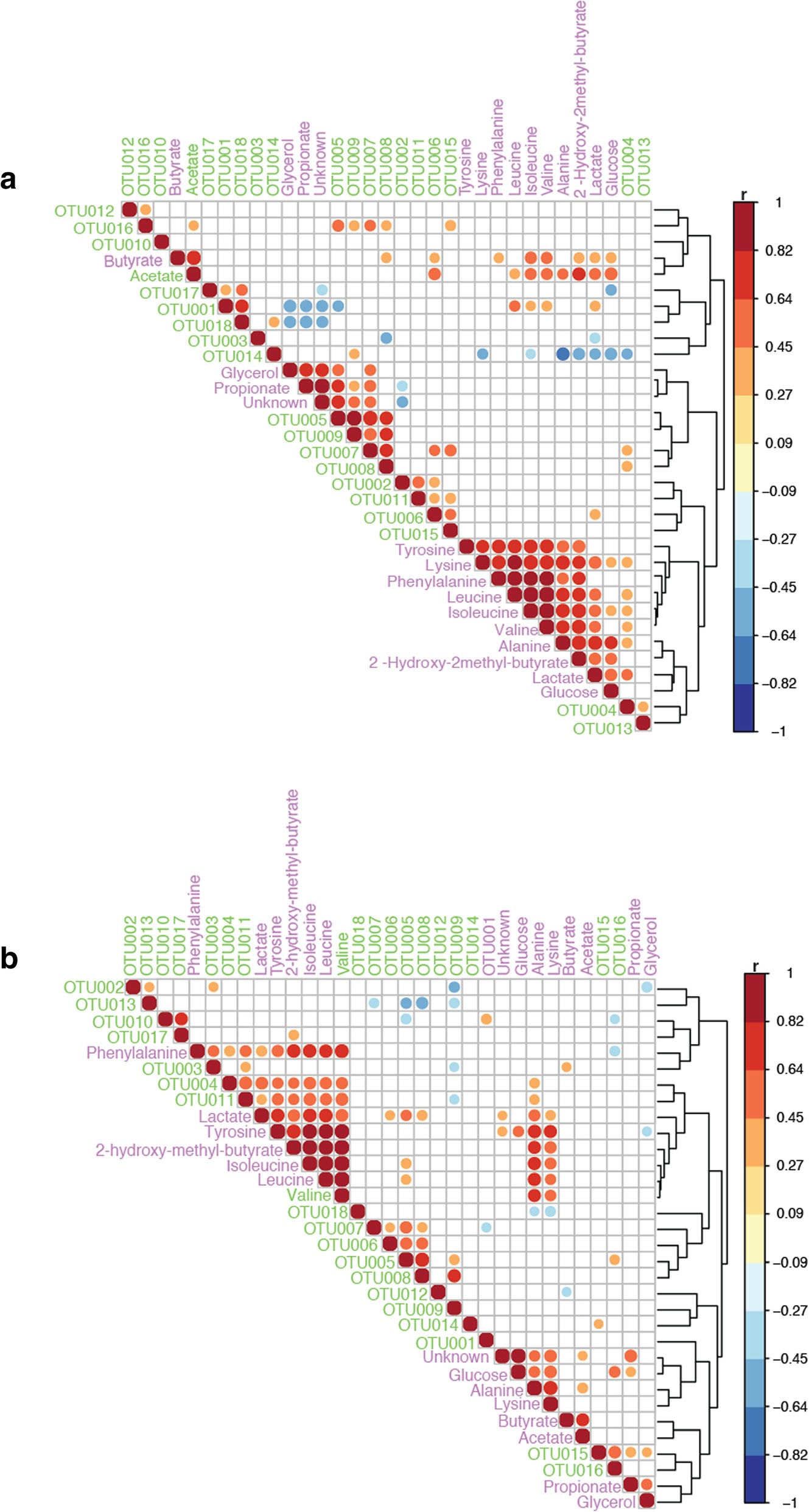
图2 总结了接受排除饮食儿童 a 和未限制饮食儿童 b 的粪便样本中细菌变化与代谢变化之间的相关性。
OUTs:细菌群;箭头:鉴定出的代谢物;方块:参与代谢途径的细菌。OTU001:双歧杆菌属;OTU002:长双歧杆菌;OTU003:考里氏菌科;OTU004:艾格特氏菌;OTU005:拟杆菌属;OTU006:脆弱拟杆菌;OTU007:卵形拟杆菌;OTU008:均匀拟杆菌;OTU009:理肯菌科属;OTU010:乳球菌属;OTU011:咽峡炎链球菌;OTU012:梭菌目;OUT013:梭菌科;OTU014:脱卤菌属;OTU015:罗氏菌属;OTU016:普拉梭菌;OTU017:粪球菌属;OTU018:嗜黏蛋白阿克曼菌
换句话说,这项研究把“自闭症与肠道菌群”的关系,从相关性提升到了可干预性。
它不意味着益生元能治愈ASD,但证明了肠–脑联动是真实存在的,并且可以被调节。
未来,当医生为自闭症儿童制定干预方案时,也许不仅仅会关注语言训练和行为疗法,还会关注他们肠道中的“微生物生态”。
结语
也许孩子的沉默,并非完全来自心灵的封闭。
有时,是肠道那片微观世界在发出求救信号。
当科学家学会倾听这些“微生物的语言”,我们也许就能找到走进他们内心的一条新路。
参考文献
Grimaldi R, Gibson GR, et al. A prebiotic intervention study in children with autism spectrum disorders (ASDs). Microbiome. 2018;6(1):133. doi:10.1186/s40168-018-0501-5.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
