当我们谈论心血管病,往往想到血脂、动脉硬化或高血压。但一项发表于 Nutrients (2023) 的综述提醒我们:真正让心脏“失衡”的,也许是藏在肠道深处的微生物。它们通过复杂的代谢通路和炎症信号,悄悄改变着血管的命运。
研究者总结了一个关键观点:心血管疾病并非单一代谢紊乱,而是一场“菌群—代谢—炎症”的三方博弈。
在代谢层面,肠道菌群将饮食中的胆碱、肉碱转化为三甲胺(TMA),经肝脏氧化生成三甲胺氧化物(TMAO)。TMAO 能干扰胆固醇外排、增强血小板聚集、促进血管内皮炎症,从而成为动脉粥样硬化的“生物燃料”。而在炎症层面,菌群失衡会导致肠屏障受损,细菌成分如脂多糖(LPS)进入血液,激活免疫系统,引发慢性低度炎症。
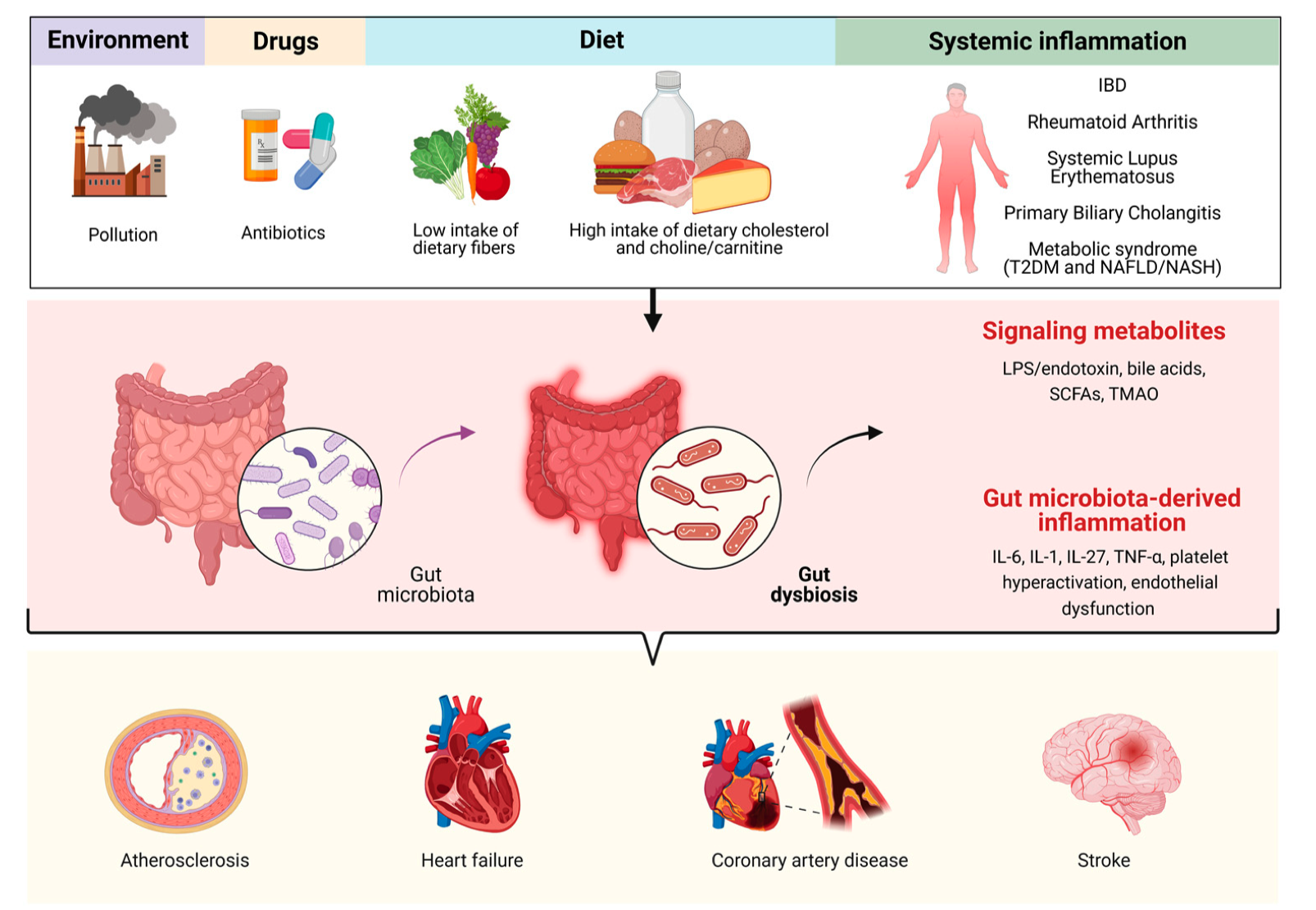
图1|环境、药物、饮食和慢性炎症会打乱肠道菌群生态,引发代谢紊乱与全身炎症,从而为心血管疾病埋下“微生物炸弹”
在这一“化学生态系统”中,几类代谢物扮演着关键角色。短链脂肪酸(SCFAs)如丁酸能激活 GPR41/GPR43 受体,促进血管舒张与抗炎反应;胆汁酸经菌群二次代谢后可调节 FXR/TGR5 信号,维持胆固醇与糖脂平衡;而 TMAO 和 LPS 则通过炎症与凝血途径放大血管损伤。
表1|主要肠源代谢物与心血管结局速览
| 代谢物 | 来源 | 主要作用通路 | 心血管效应 |
|---|---|---|---|
| TMAO | 膳食胆碱、肉碱 → 肠菌 CutC/D 酶 | 干扰胆固醇外排,促炎促凝 | 增加动脉粥样硬化风险 |
| SCFAs | 膳食纤维发酵产物 | GPR41/GPR43 激活,抗炎 | 改善血压与代谢稳态 |
| 次级胆汁酸 | 初级胆汁酸经菌群代谢 | FXR/TGR5 通路调节代谢 | 调脂与抗炎双重作用 |
| LPS | 革兰阴性菌外膜成分 | TLR4/NF-κB 信号激活 | 慢性炎症、内皮功能障碍 |
论文的亮点之一,是提出了“肠道菌群—炎症因子互作环(microbiota–cytokine feedback loop)”。菌群失衡导致 LPS、TMAO 等信号升高,激活免疫细胞释放 IL-6、TNF-α 等炎症因子;这些因子反过来改变肠屏障通透性与菌群结构,形成恶性循环。
临床证据正在积累。研究显示,TMAO 与 IL-6 水平升高可预测心肌梗死和心衰事件风险;而补充益生菌或高纤维饮食能降低这些标志物,改善血管功能。部分动物实验表明,抑制 TMA 生成酶 CutC 或靶向 FXR 通路,能显著延缓动脉粥样硬化进程。这一切都指向一个新理念:治心脏病,或许要先“养肠”。
然而,科学家也提醒,菌群干预并非万能。菌群生态因人而异,个体饮食、药物、基因均会改变菌群功能。因此,未来的方向是“个体化微生物治疗”——结合代谢组学与人工智能,预测每个人的菌群响应,再制定个性化饮食与益生菌方案。
这篇综述的结论充满前瞻性:心血管疾病是一种系统性微生物-宿主代谢失衡。 未来的心脏医学,将不止关注血压与胆固醇,更要描绘每个人体内那张“看不见的菌群网络”。
参考文献
Ponziani F.R., et al. (2023). Gut Microbiota and Cardiovascular Disease: Evidence on the Metabolic and Inflammatory Background of a Complex Relationship. Nutrients, 15(4), 925. https://doi.org/10.3390/ijms24109087
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
