血管,是生命最精密的运输网络。但我们鲜少意识到,这张庞大的“管道系统”从诞生之初就离不开一个微小的合作者——肠道菌群。2023 年发表在 Cold Spring Harbor Perspectives in Medicine 的综述指出,肠道微生物不仅影响消化与免疫,还直接调控全身微血管(microvasculature)的发育与功能,从肠道乳糜管到脑血屏障,它们几乎无处不在。
研究者发现,在无菌动物模型中,肠道绒毛的毛细血管与乳糜管(lacteals)发育严重受阻,血管网络稀疏,内皮细胞排列紊乱。补充特定菌群后,这些血管得以恢复。关键机制在于:肠道菌群通过短链脂肪酸(SCFAs)信号调控血管内皮生长因子(VEGF-C)与 Notch 通路,从而诱导毛细血管与乳糜管的正常分化。这意味着,血管的“施工蓝图”部分掌握在微生物手中。
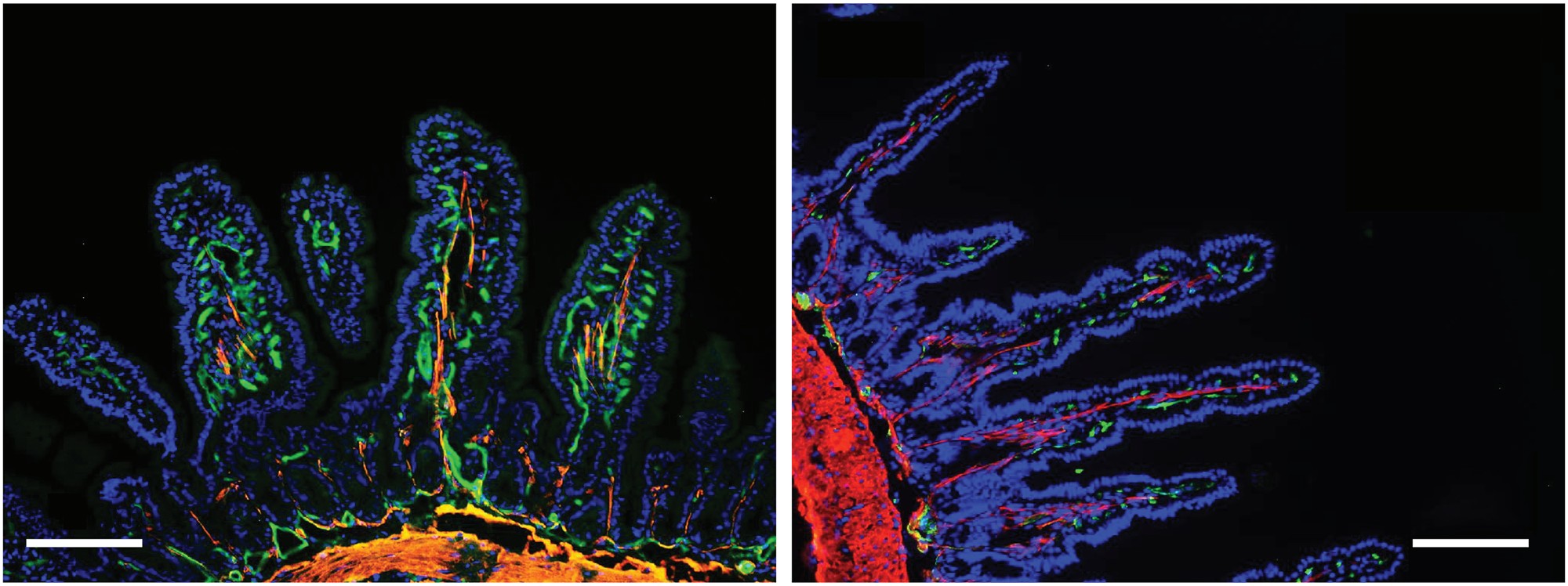
图1|有菌小鼠(左) vs 无菌小鼠(右):肠道微生物让血管“更密集”
更令人惊讶的是,这种血管调控不仅限于肠道。肝脏、脑、心脏乃至视网膜的微血管,都受肠源信号的“远程控制”。
论文指出,肠道菌群可通过凝血与免疫通路共同影响血管稳态。当菌群紊乱时,肠屏障通透性增加,LPS 与微生物代谢物进入血液,激活tissue factor–PAR1(凝血因子–蛋白酶激活受体)轴。这一信号通路促进血管内皮炎症与渗漏,触发微循环障碍,也与糖尿病视网膜病变、肝窦内皮功能障碍等密切相关。
表1|不同器官微血管受菌群调控的实例汇总
| 器官 | 关键菌群/代谢物 | 作用机制 | 功能影响 |
|---|---|---|---|
| 肠道 | SCFAs-producing bacteria | 调节 VEGF-C/Notch,促进毛细血管形成 | 维持吸收与屏障功能 |
| 肝脏 | LPS-producing bacteria | 激活 TLR4 与 PAR1,诱导窦状内皮重塑 | 增加炎症与纤维化风险 |
| 脑 | Akkermansia, Bifidobacterium | SCFAs 促进血脑屏障紧密连接蛋白表达 | 保护神经血管单元稳态 |
| 视网膜 | Dysbiotic flora | LPS 与 ROS 激活内皮 VEGF-A 过度生成 | 导致异常血管增生 |
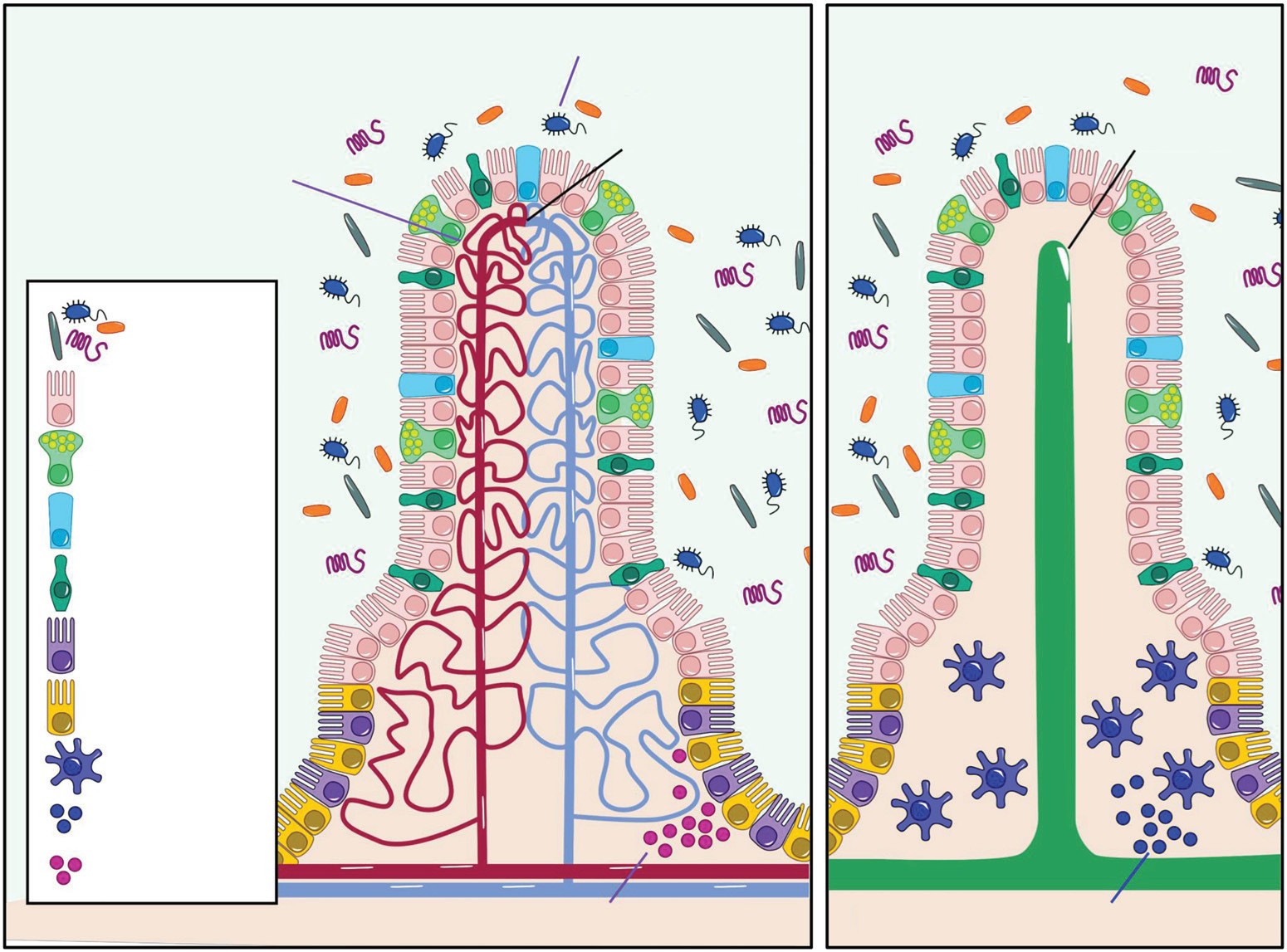
图2|肠道菌群促进血管与淋巴管的成熟机制
左图:血管网络的扩展
肠道绒毛(像一根根手指)内部充满毛细血管。肠道菌群释放信号分子,激活免疫细胞(如先天免疫受体TLR),促进血管新生。结果毛细血管网络增密,吸收面积扩大,代谢物运输更高效。
右图:淋巴管的成熟
每根绒毛中间有一根乳糜管(lacteal),负责吸收脂肪。肠菌代谢物(如短链脂肪酸)刺激旁边的Paneth细胞与免疫细胞,促进乳糜管壁发育。因此淋巴管更成熟,脂质运输更顺畅。
这项综述提出一个大胆观点:微血管系统是肠道菌群信号的“投影地图”。 不同器官根据所接收到的菌群代谢与免疫信号,调节自身的血管密度、通透性与修复能力。比如在脑中,丁酸能通过抑制 HDAC 改善血脑屏障功能;在肝脏,TMAO 与 LPS 却可能触发凝血级联反应,引发微循环炎症。
论文特别强调了“凝血—炎症—微血管”三者的交叉节点:tissue factor–PAR1 轴。它既能感知肠源炎症信号,又可激活血管内皮细胞,使局部形成“微型炎症热点”。这种机制解释了为何菌群紊乱常伴随血管渗漏、局部缺血或高凝状态。
科学家由此提出新的临床假说:调控菌群,也许能间接改善微血管功能。 动物实验显示,补充产 SCFAs 的 Akkermansia 或 Clostridium butyricum 可降低微循环炎症水平,恢复血管稳定性;而抑制 PAR1 信号可部分阻断菌群失衡引起的血管病变。这些结果正在推动“微血管靶向益生疗法”的出现。
微血管是生命的最小公共单位,而肠道菌群是它的生态调节器。未来,医学或许不再把血管看作单一的解剖结构,而是一张与微生物共生的生理网络——一旦通信失调,心、脑、肝、肠的微循环便会同时陷入混乱。
正如作者总结:“Microbes shape vessels, and vessels sustain microbes.” 微生物塑造血管,而血管反过来养育微生物。这种跨越尺度的共生,也许正是生命稳定运行的隐形支柱。
参考文献
Reinhardt C., et al. (2023). Gut Microbiota and the Microvasculature. Cold Spring Harbor Perspectives in Medicine.
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
