肥胖、糖尿病、脂肪肝,这些被归类为“生活方式病”的现代流行病,或许并非仅仅源自热量过剩。2016 年发表在 Genome Medicine 的一篇重磅综述提出了一个颠覆性观点:肠道菌群是代谢失衡的隐形操纵者。
由英国帝国理工学院的 Jeremy Nicholson 与 Marc-Emmanuel Dumas 团队撰写的这项研究,系统揭示了肠道菌群如何通过代谢与炎症通路,重塑能量利用与免疫平衡,从而推动肥胖与代谢疾病的发生。
研究者发现,肠道菌群构成的细微变化足以影响宿主的能量分配。健康菌群通过发酵膳食纤维产生短链脂肪酸(SCFAs),激活 GPR41/GPR43 受体,调节 AMPK、FIAF(脂蛋白脂酶抑制因子) 等信号通路,从而提高能量消耗并抑制脂肪储存。相反,当菌群失衡、产毒菌增加时,代谢网络被彻底改写。
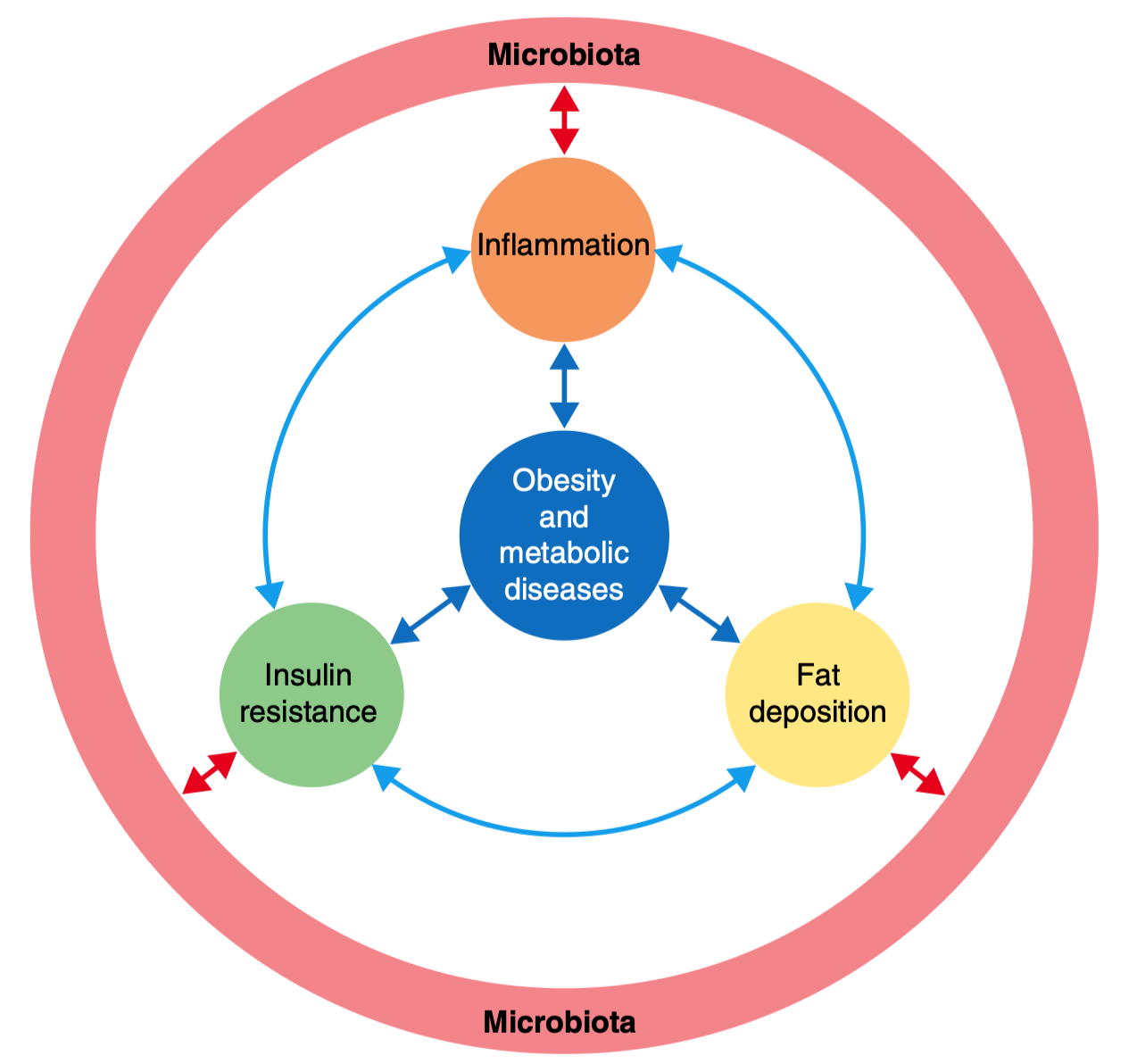
图1 | 肠道菌群通过一系列分子信号引发炎症、增加脂肪堆积、削弱胰岛素作用,三者互相促进,最终形成一个“肥胖–代谢紊乱–肠道菌群失衡”的恶性循环
这篇论文首次提出了一个重要概念——“代谢性内毒血症(metabolic endotoxemia)”。研究显示,高脂饮食可导致肠道屏障受损,使革兰阴性菌外膜的脂多糖(LPS)进入血液。LPS 激活免疫受体 TLR4–NF-κB 通路,引发低度、持续性的炎症反应。虽然这种炎症程度远低于感染,但却足以干扰胰岛素信号,诱发胰岛素抵抗与脂肪堆积。
换句话说,肥胖不只是多吃的问题,而是身体长期处于“轻度炎症模式”。
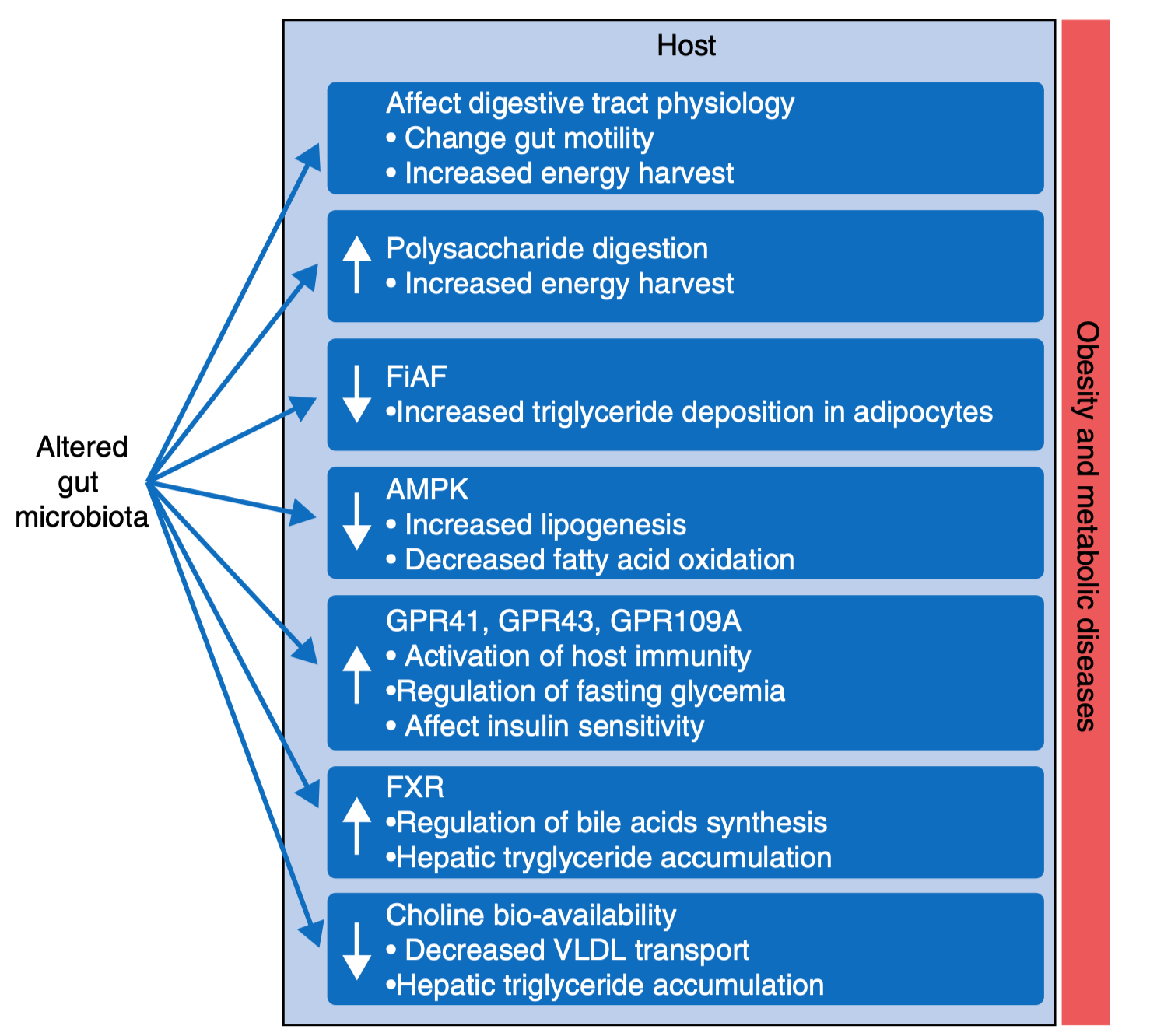
图2 | 当肠道菌群失衡时,它会通过多种信号通路改变人体的能量利用方式、脂肪代谢和炎症水平,从而推动肥胖和代谢紊乱的发生
与此同时,肠道菌群还通过多条代谢通路调控宿主的能量系统。菌群产生的次级胆汁酸能激活 FXR 与 TGR5 受体,调节糖脂代谢;吲哚类代谢物(如吲哚-3-丙酸、3-indoxylsulfate)则参与免疫稳态与肠屏障维护。论文指出,这些信号分子构成了肠道与代谢器官(肝、脂肪、肌肉)之间的化学通信网络。
表1|肠源信号分子与代谢效应速览
| 信号分子 | 主要来源 | 作用受体/通路 | 代谢效应 |
|---|---|---|---|
| SCFAs(短链脂肪酸) | 膳食纤维发酵 | GPR41/43, AMPK | 增加能量消耗、抗炎 |
| LPS | 革兰阴性菌外膜 | TLR4–NF-κB | 诱发慢性炎症与胰岛素抵抗 |
| 吲哚及其衍生物 | 芳香族氨基酸代谢 | AhR, IL-22 通路 | 改善屏障、调节免疫 |
| 次级胆汁酸 | 肠菌二次代谢 | FXR, TGR5 | 调节糖脂代谢与胆固醇平衡 |
论文进一步指出,菌群失衡(dysbiosis)会放大这些代谢信号的病理效应。例如,高脂饮食降低双歧杆菌与厚壁菌比例,导致 LPS 泄漏与炎症增强;抗生素干扰可使胰岛素敏感性下降;而粪菌移植实验则证明,肥胖者的菌群足以“传染”代谢异常给受体动物。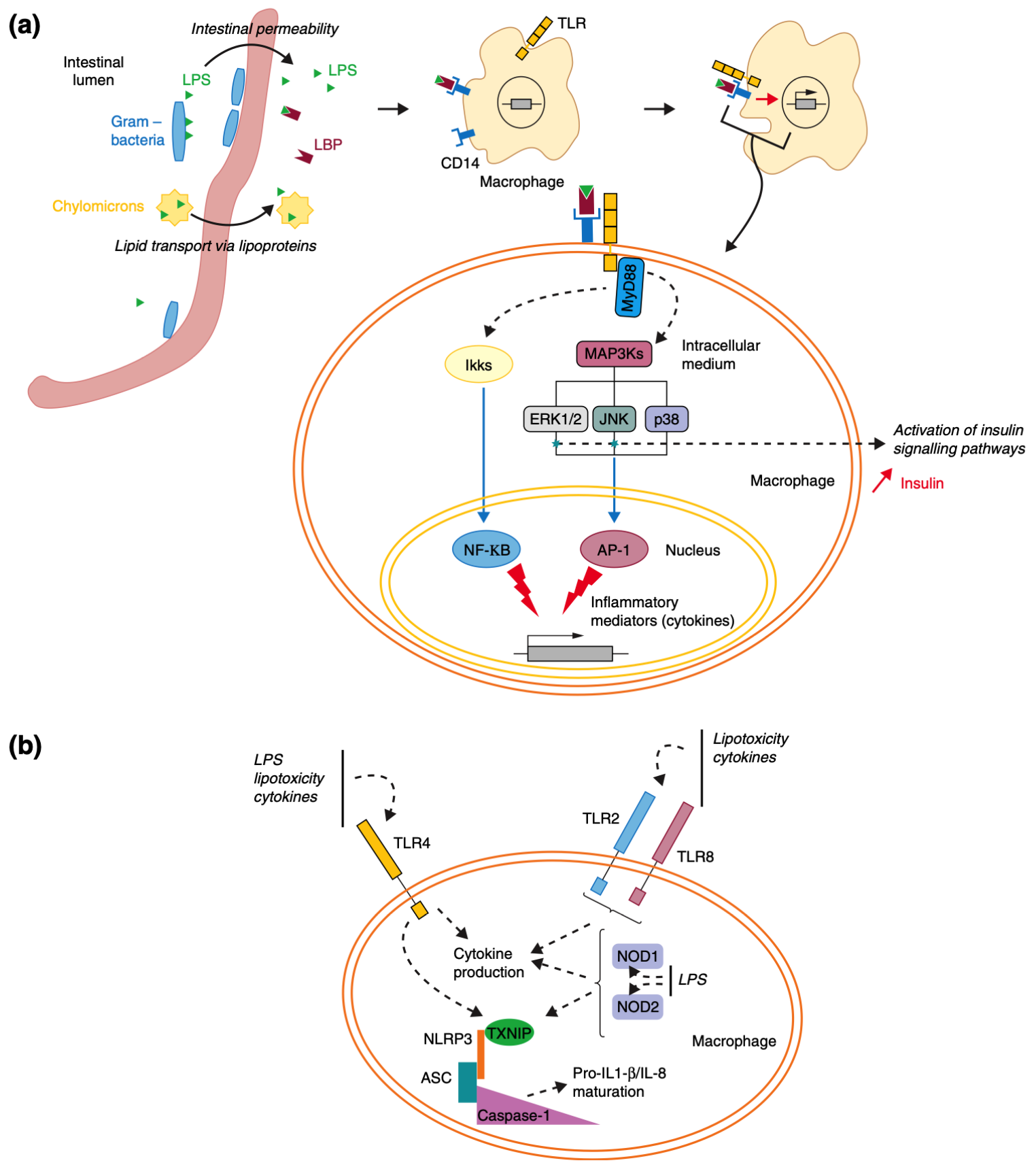
图3 | “肠道菌群失衡 → 炎症激活 → 胰岛素抵抗”的分子机制
当肠道菌群失衡导致细菌成分(如LPS)进入体内后,会激活免疫受体(TLR、NOD),触发炎症信号(NF-κB、MAPK等),并干扰胰岛素信号传导,最终导致慢性炎症和胰岛素抵抗
令人欣慰的是,干预途径正在形成。补充 益生菌(如 Lactobacillus、Bifidobacterium)、摄入益生元纤维(如菊粉、抗性淀粉)、甚至通过粪菌移植(FMT)重塑菌群,均显示改善胰岛素敏感性与代谢稳态的潜力。这些策略的核心,不是“杀菌”,而是重新建立微生态平衡。
最终,作者提出了一个前瞻性框架:代谢疾病本质上是一种“微生态失衡综合征”。 它的起点在肠道,路径是炎症,终点是代谢崩塌。未来的代谢治疗,可能从计算热量转向计算微生物。
正如论文总结所言:“The gut microbiota is not a passenger of metabolism—it is a driver.” 肠道菌群不是代谢的乘客,而是掌舵者。
参考文献
Nicholson J.K., Dumas M.E., et al. (2016). Impact of the Gut Microbiota on Inflammation, Obesity, and Metabolic Disease. Genome Medicine, 8(42), 1–14. https://doi.org/10.1186/s13073-016-0303-2
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
