几十年来,高血压和慢性肾病(CKD)被认为是独立的疾病,但 2018 年发表在 Nature Reviews Nephrology 的综述颠覆了这一观点。来自佛罗里达大学的 Mohan K. Raizada 团队提出了一个革命性的概念:“脑–肠–肾轴(Brain–Gut–Kidney Axis)”。他们发现,肠道微生物通过代谢、神经与免疫信号将大脑、肠道和肾脏连接成一个互相影响的生态网络。
在健康状态下,肠道菌群维持着代谢与免疫平衡。产短链脂肪酸(SCFAs)的菌株,如 Faecalibacterium prausnitzii 与 Roseburia intestinalis,能生成丁酸、丙酸等分子,调节血管舒张与抗炎反应。但在高盐饮食、肥胖或慢性应激状态下,这种平衡被打破:有害菌增多,肠屏障受损,内毒素(LPS)进入血液,引发肾脏炎症和血压升高。
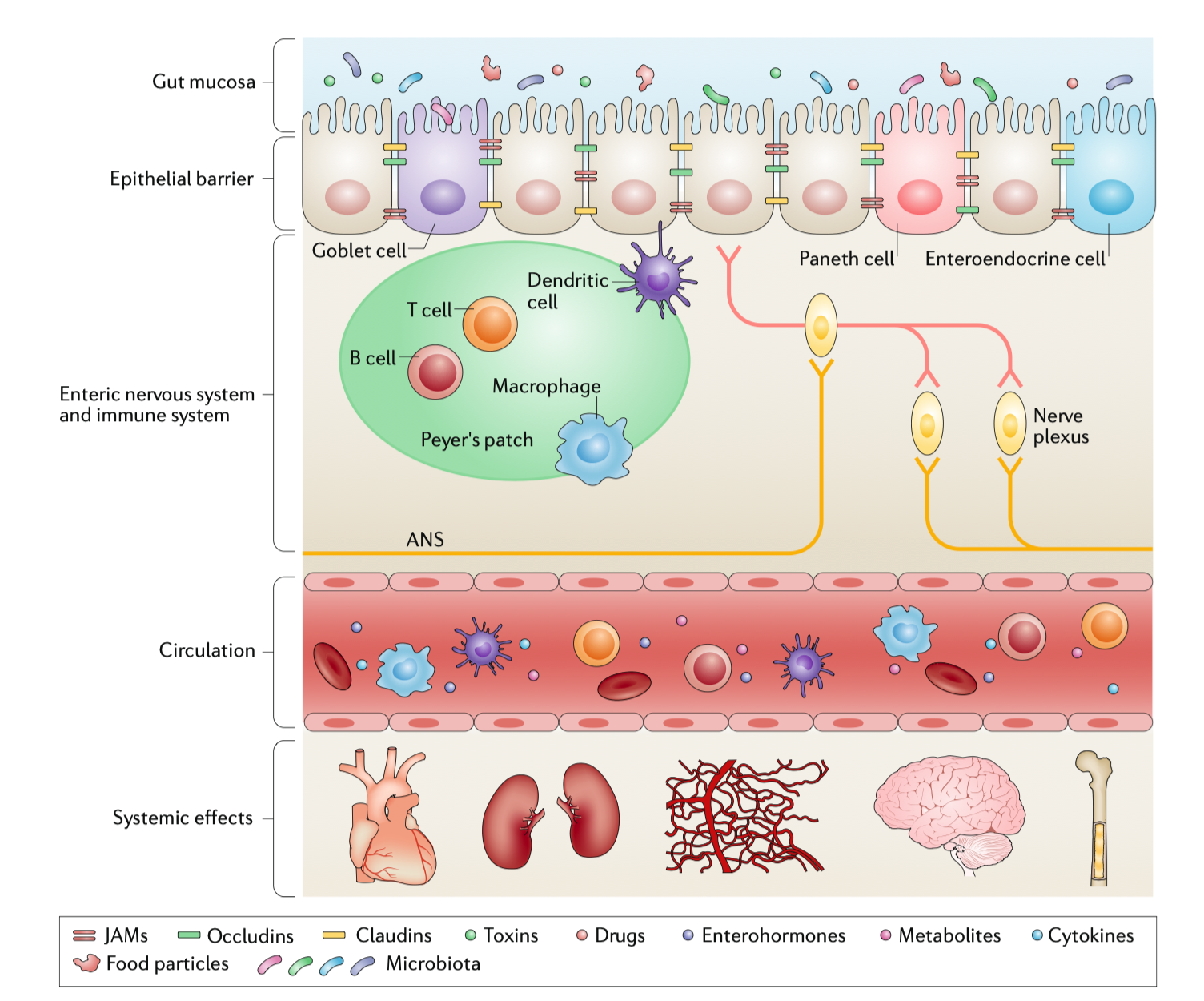
图1|肠道与多系统交互示意图
研究团队揭示,肠–肾轴是这条网络的“代谢中枢”。肠源代谢物如 吲哚硫酸盐(IS) 和 对甲酚硫酸(PCS) 在肠屏障破裂后进入血液,激活肾小管的 TLR4–NF-κB 通路,促进氧化应激与纤维化。与此同时,三甲胺氧化物(TMAO) 则通过干扰胆固醇代谢与血管内皮功能,进一步加剧动脉硬化与肾脏损伤。
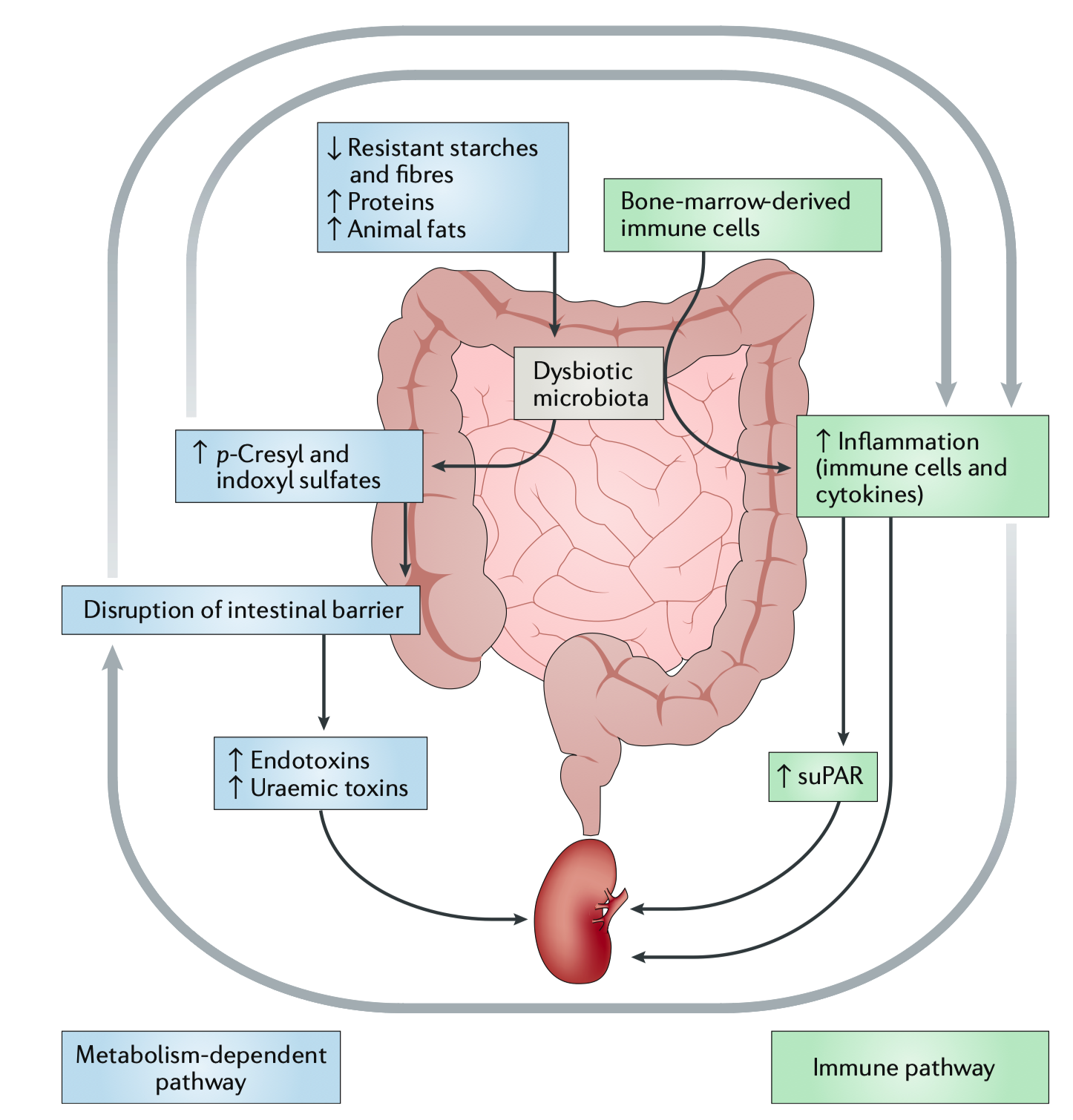
图2|肠–肾轴代谢与免疫双通路模型
与此同时,大脑并非“旁观者”。研究发现,肠道菌群可通过迷走神经与交感神经直接影响脑干的血压调控中枢。当肠源信号导致交感神经过度兴奋时,血管收缩、肾素释放与肾脏灌注下降形成恶性循环。反之,迷走神经的激活能抑制炎症反应,发挥“抗压”作用。这种三向通信让高血压和肾病不再是局部问题,而是全身神经–免疫–代谢共振的产物。
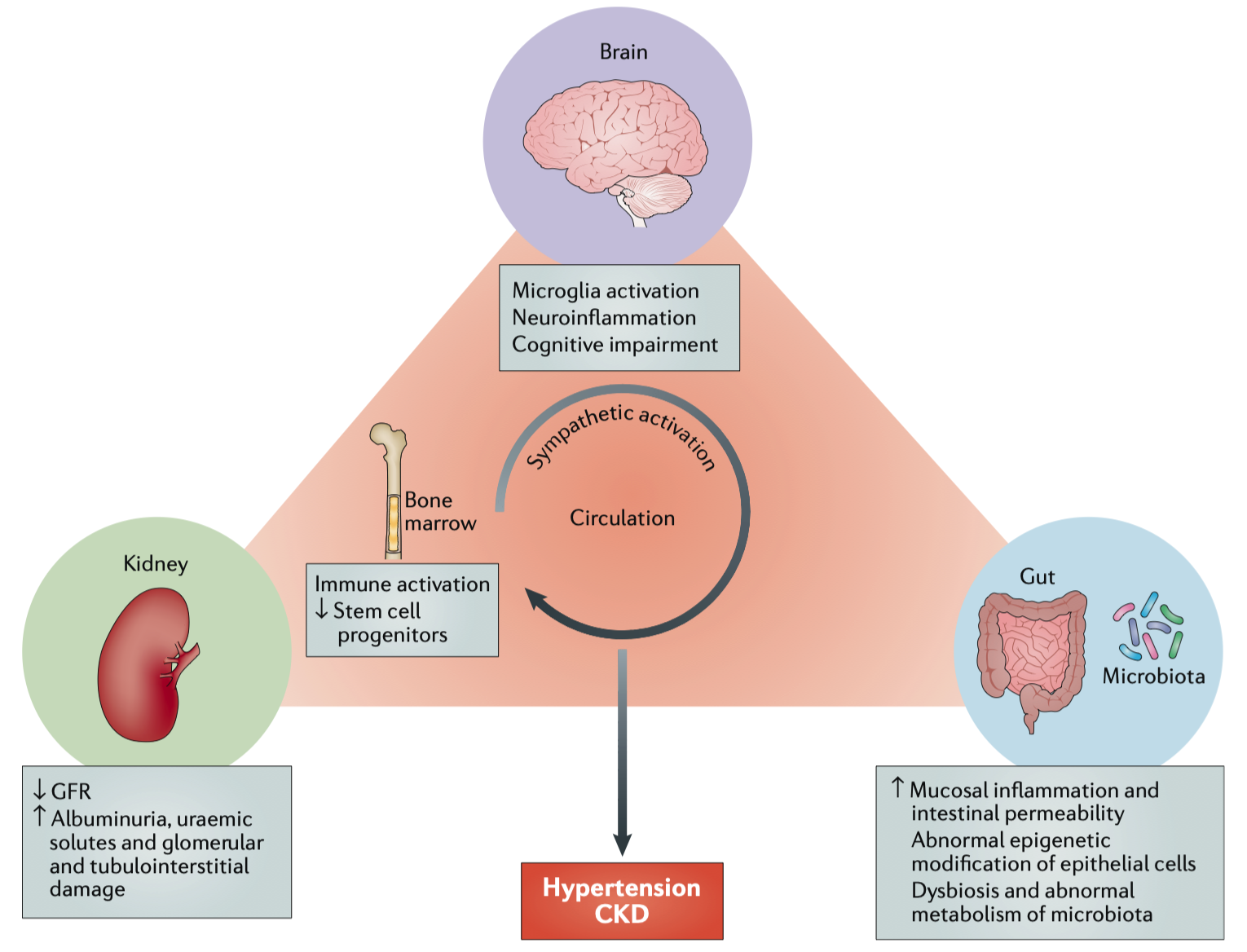
图3|脑–肠–肾轴的病理环路总览
表1|高血压与 CKD 患者的肠道菌群变化对照表
| 菌群变化 | 代表菌属 | 主要代谢物 | 病理效应 |
|---|---|---|---|
| 益生菌减少 | Lactobacillus, Bifidobacterium | SCFAs ↓ | 抗炎能力下降,血压升高 |
| 有害菌增加 | Enterobacteriaceae, Clostridium | LPS ↑, TMAO ↑ | 炎症与内皮损伤 |
| 芳香代谢菌紊乱 | Bacteroides, Prevotella | 吲哚衍生物 ↓ | 肾毒素积累,氧化应激 |
表观遗传调控:微生物如何“改写”肾脏基因表达
论文提出的另一个创新点是表观遗传层面的肠–肾通信。研究发现,丁酸等 SCFAs 可抑制 组蛋白去乙酰化酶(HDAC),增加肾脏抗氧化基因表达;而尿毒素 IS、PCS 则促进 DNA 甲基化与组蛋白乙酰化异常,沉默肾保护基因(如 Klotho、Nrf2)。这意味着,肠道微生物不仅能“影响”肾脏,还能在分子层面“编程”肾脏命运。
展望未来,研究者认为重塑脑–肠–肾轴可能成为治疗高血压与 CKD 的新方向。策略包括:
●高纤维与低盐饮食:恢复产 SCFA 菌群,降低炎症;
●益生菌与益生元:如 Akkermansia muciniphila 可强化屏障功能;
●尿毒素吸附剂(AST-120):减少有害代谢物回流;
●靶向神经信号调节:通过刺激迷走神经抑制交感活性。
最终目标,是以“微生态–代谢–神经–免疫”四维整合方式,实现个体化控压与肾脏保护。
正如作者所言:“The gut is not an isolated organ—it is the conductor of systemic health.” 肠道不再是被动的消化器官,而是调节血压与肾功能的“生物枢纽”。
参考文献
Pluznick J., Raizada M.K., et al. (2018). The Gut Microbiota and the Brain–Gut–Kidney Axis in Hypertension and Chronic Kidney Disease. Nature Reviews Nephrology, 14(7), 442–456. https://doi.org/10.1038/s41581-018-0018-2
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
