从古到今,长生不老一直是很多人追求的目标,上到帝王将相,下到烂柯樵夫。然而,无论是谁都没有熬过岁月的流逝,以至于诗人写下了“人生七十古来稀”的慨叹。
当然,如今人类寿命已经得到了很大的改善,比如我国居民人均预期寿命已经达到了 79 岁。这背后,卫生健康、经济社会等因素都起到了重要作用。这也让很多人好奇,我们的预期寿命能否无限上升呢?

图库版权图片,转载使用可能引发版权纠纷
寿命极限似乎有尽头
虽然传说中有 800 岁的彭祖,但是现实中,能够经得住多重验证的长寿老人却似乎没这么高龄,比如目前吉尼斯世界纪录认证的最长寿者是 122 岁,其他一些声名远扬的长寿老人也大致在这个年龄段附近。
难道,人类寿命真的有极限吗?
对此,一开始科学家们是不太相信的,来自动物的实验表明,我们是可以通过对动物的干预来让动物突破它们的寿命极限,而过去上百年来,我们的人均预期寿命是不断攀升的,比如从 1840-2017 年期间,来自多个区域的人群人均预期寿命都发生了显著的上身,甚至某种程度上,它们拟合是线性的,这让我们觉得,既然人均预期寿命都在如此上升,那人类的极限寿命自然也应该是如此。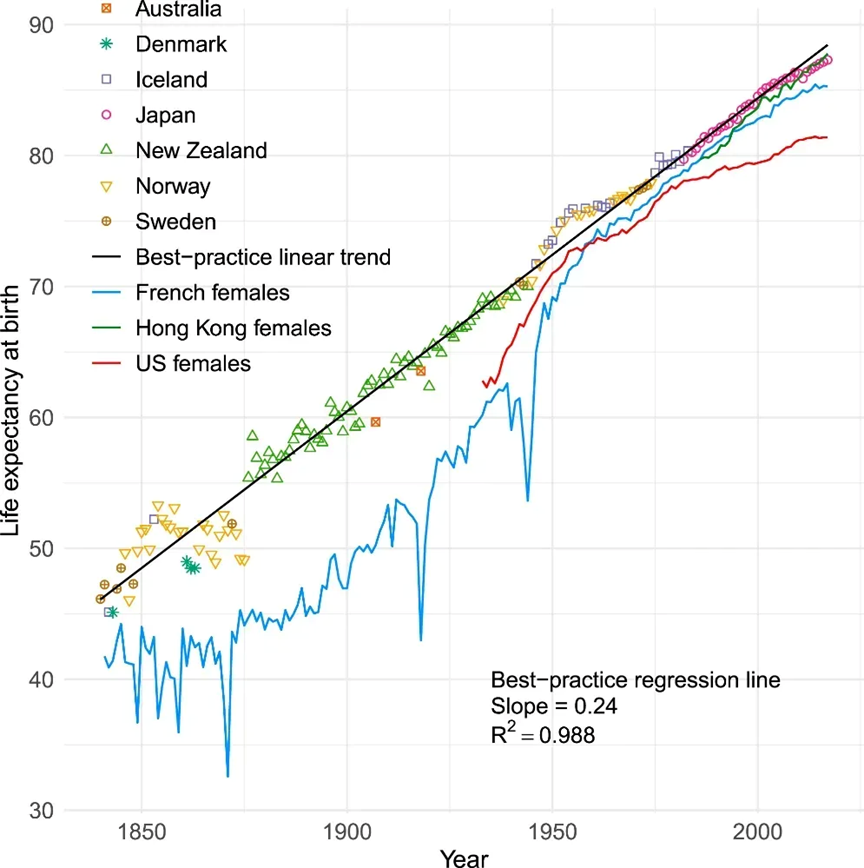
过去 150 年间人类预期寿命变化 [1]
然而,当科学家们单独的把长寿人群数据列出来进行研究,却发现并非如此。研究人员统计了 1900 年以来人群的生存率情况,发现这个数字并不是一直上升,而是到了 90 多岁后开始迅速下降,这意味着,当人群寿命在一定程度上触碰到了某种隐藏的上限。
当然,很多人还是非常相信各种其他因素对于寿命的影响,比如经济社会、医药卫生等对于寿命的改善,这些的确在过去相当长的时间里发挥了明显的作用,但是随着时间的推进,这种助力速度也慢慢放缓了,尤其是进入了 1980 年后,这个数字总体趋于平稳了。
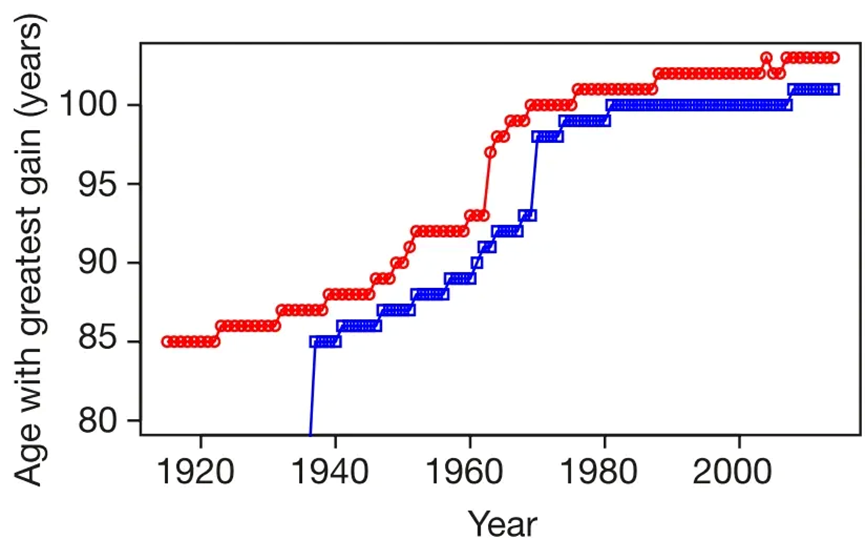
这一切,都似乎在告诉我们,人类寿命似乎并不是无限高的,而是有一个上限在那里。研究人员不信邪,他们干脆从国际长寿数据里把那些各个国家每年报告的最大死亡年龄(当年去世的最长寿的人)做了一个统计,这其中不少人已经达到了 110 岁的超级长寿水平。结果发现,以 1995 年为界分为两组,1968 年-1994 年间,这个数字是总体呈现了上升趋势,也就说,这些年间,每年去世的最高年龄呈现了上升去世,但是从 1995-2006 年间,这个趋势不仅没有增加,反而呈现了下降趋势,甚至把当年去世的第二、三、四、五高龄纳入进去,这个趋势依然成立。
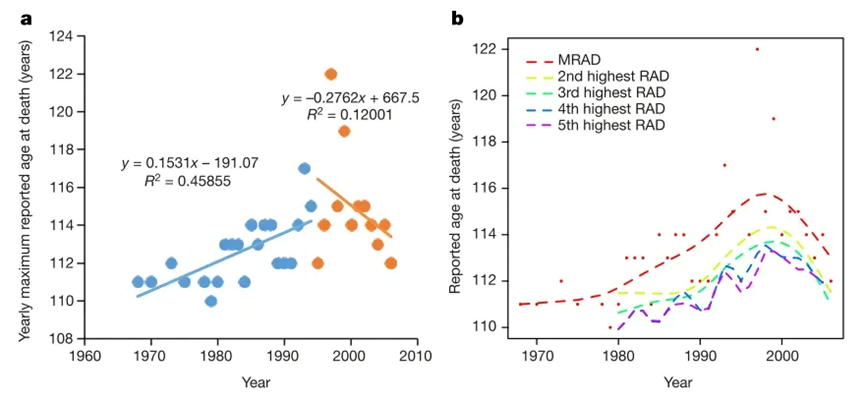
这些统计数据表明,人类寿命的极限是存在的,根据计算,研究人员最后得出了这个人类寿命的极限:125 岁。
为什么人类的寿命极限
在 100 多岁?
看到这个数据,估计不少人会诧异、好奇,为什么人类的极限寿命会卡在这个年龄?很早之前就有学者通过对性成熟和寿命的关系进行了探究,他们提出哺乳动物的最高寿命约为性成熟年龄的 8-10 倍左右,按照人类初次性成熟 12-13 之间,可以推测这个极限寿命大概是在 120-130 之间。
这套体系甚至可以和进化关联上,繁殖会和种群规模存在较大关系,比如繁殖周期、繁殖率高就容易导致群体规模增加,如果再叠加生存率高,很快就会让所处的生态环境无法承受而难以发展下去,结果就自然会在这些参数上有所调整,比如寿命、比如繁殖等,这就是进化上的一种约束。比如繁殖率高的物种如小鼠往往寿命短,而繁殖率低、性成熟晚的动物如格林兰鲨寿命更长。以人类的性成熟、繁殖率和生存率,如果极限寿命再高,也容易受到类似的约束导致生态无法承载,最终就压制下来了。
当然,这一套理论其实并没有那么严谨,尤其是随着学者对越来越多的动物极限寿命进行探究,发现这个倍数并不是一个恒定的参数,过去的认知不少是一种过度的拟合[2][3]。
后来上世纪 60 年代,海夫利克在研究细胞的时候发现,正常人体细胞在体外培养时,其分裂次数最高只能是 40-60 次左右,这就是海弗里克极限,而根据细胞更新大概 2-2.5 年来推测, 那么人类的极限寿命可能也是 120 岁左右。
我们也可以进一步追问为什么体外培养细胞会出现海夫利克极限,一个直观的原因在于端粒,也就是染色体末端的一个大概有 10000 碱基长度的保护性结构,这个结构会随着细胞复制而每次缩短 50-200 个碱基,当端粒缩短到约 4000-5000 碱基这个临界长度时,细胞停止分裂并进入衰老状态,这样算下来倒也能和海夫利克极限对的上。不过这种观点也并非完全合理,比如体内和体外环境并不一致,且端粒缩短并非是所有生命都会如此迅速,甚至于许多生命根本就不受端粒复制的影响,比如单细胞生命就可以无限复制,不少生命如植物还存在端粒修复策略。
其实这些都是一些相对于容易理解和接受的观点,而从进化适应的角度来说,过于长寿对于人类而言,并不是一种十分划算的策略。
一方面,极端长寿的代价太高。
生命的基本特征之一就是新陈代谢,而这个过程就会产生损伤,比如我们机体氧化磷酸化为全身提供 ATP 的过程就会随机产生氧自由基,这些高能的氧自由基会随机破坏细胞的 DNA、蛋白质、细胞器等,尽管机体有一定的修复能力,但是并不能完全修复,这种损伤会持续积累。
类似我们的 DNA 复制也非完全精确,虽然有相应的修复机制但也无法 100% 修复,所以错误也会积累,其他诸如细胞内稳态、表观遗传、线粒体功能障碍等都是会随着时间的推进不断加剧,而同时,我们无论是修复能力还是营养机能都会下降,导致对抗衰老的代价越来越高,这些因素最终会导致机体无法避免的走向衰老。

图库版权图片,转载使用可能引发版权纠纷
另一方面,极端长寿本身在适应上存在不足。
相信大家都熟悉“物竞天择、适者生存”的进化论,事实上,在生命进化史上,如何适应环境对于许多生命来说至关重要,许多物种由于不能适应环境变化而直接走向了灭绝。对于多细胞生物来说,一旦成长起来,其基因改变是极其困难的,因此面对地质、气候变化往往非常被动,通过生殖遗传重组才能产生更多样化的性状,从而可以让下一代相对适应变化,因此面对进化压力,选择长寿并不是个优选。
基于这些认知和理解,我们也可以看出,对于人类来说,寿命极限突破似乎并不是一件划算的事情。
科技加持下,
极限寿命会有突破吗?
尽管长寿似乎并不是一件进化上的优选,但是,现代科技的发展已经取得了很多进展,那么未来我们能否依靠科技来突破极限寿命吗?
答案是有可能的。
一般谈到极端长寿,我们会想到长寿的另一面:衰老。
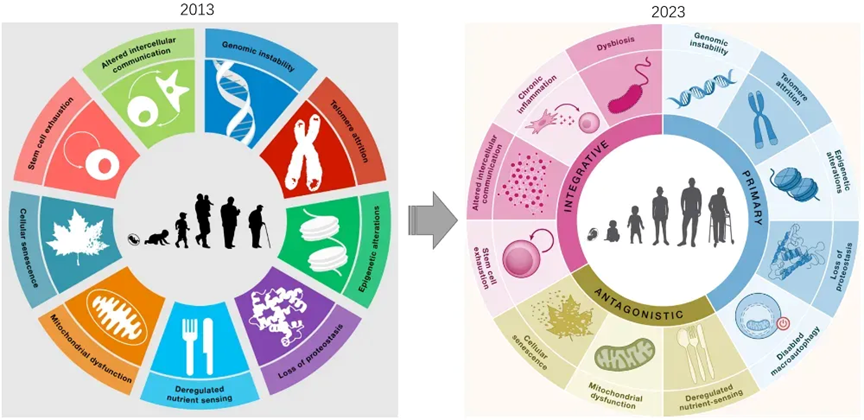
从宏观层面,衰老表现出了机体机能的下降、疾病的发生等,而在微观层面上,现在对于衰老的研究已经非常深入,比如从 2013 到 2023 年两篇综述文章先后对衰老机制进行了总结,包括基因组不稳定,端粒缩短,表观遗传改变、慢性炎症等十多个机制[4][5]。
这些机制不仅揭示了衰老发生了什么,还为我们提供了改变衰老的可能性。比如端粒是很多人耳熟能详的决定细胞寿命的结构,端粒缩短会导致细胞寿命减少,那么我们如果改变端粒,是否就可能改变细胞命运呢?目前我们已经寻找到了这种成分,那就是端粒酶[6]。同样,传统衰老过程中出现细胞总体衰老,包括我们的干细胞也被耗竭,如果可再生的干细胞能够源源不断供给呢?比如科学家们发现的人工诱导多能干细胞[7]。
这些技术极具潜力,但在“将其安全、有效地用于大规模延长人类最大寿命”之前,仍需解决癌变风险、长期功能整合、免疫排斥、社会公平等重大的生物学与伦理难题。可以说,基于传统认知,我们无论从进化还是细胞分子机制上,都面临着寿命极限的难题。但是,在现代科技加持下,我们极大可能改变决定这一切的基础,直接改变传统生物学对寿命的决定和影响,也许未来极限寿命会真正获得突破。
参考文献
[1]J.W. Vaupel,F. Villavicencio,& M. Bergeron-Boucher,Demographic perspectives on the rise of longevity,Proc. Natl. Acad. Sci. U.S.A. 118 (9) e2019536118,
[2]Prothero J. Adult life span as a function of age at maturity. Exp Gerontol. 1993 Nov-Dec;28(6):529-36.
[3]Sean Nee et al.The Illusion of Invariant Quantities in Life Histories.Science309,1236-1239(2005).
[4]López-Otín, Carlos, et al. "The hallmarks of aging." Cell 153.6 (2013): 1194-1217.
[5]López-Otín, Carlos, et al. "Hallmarks of aging: An expanding universe." Cell 186.2 (2023): 243-278.
[6]Greider C W, Blackburn E H. Identification of a specific telomere terminal transferase activity in Tetrahymena extracts[J]. cell, 1985, 43(2): 405-413.
[7]Takahashi, Kazutoshi, and Shinya Yamanaka. "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors." cell 126.4 (2006): 663-676.
[8]Loupy, Alexandre, et al. "Immune response after pig-to-human kidney xenotransplantation: a multimodal phenotyping study." The Lancet 402.10408 (2023): 1158-1169.
本文为科普中国·创作培育计划扶持作品
出品丨中国科协科普部
监制丨中国科学技术出版社有限公司、北京中科星河文化传媒有限公司
作者丨李雷 中国科学院遗传学博士
审核丨李旭 中国科学技术大学副教授 中国生物化学与分子生物学会会员
来源: 科普中国创作培育计划
内容资源由项目单位提供


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 科普中国创作培育计划
科普中国创作培育计划 
