人们早已知道“肠脑轴”连接着情绪、免疫与代谢,但2021年发表在 Gut 的一项研究首次证明,这条通信通路在卒中时会变成“双刃剑”。由南方医科大学朱健康团队完成的研究揭示:脑卒中可在短短数小时内引发肠道菌群剧烈失衡,而这种失衡反过来又加重脑损伤。
研究人员利用小鼠模型发现,脑缺血发生后仅3小时,肠道菌群结构就出现急剧改变。正常情况下占主导的厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)数量下降,而肠杆菌科(Enterobacteriaceae)暴发性增殖。这种变化不是长期饮食或炎症积累的结果,而是卒中引起的系统性缺血–再灌注反应所致。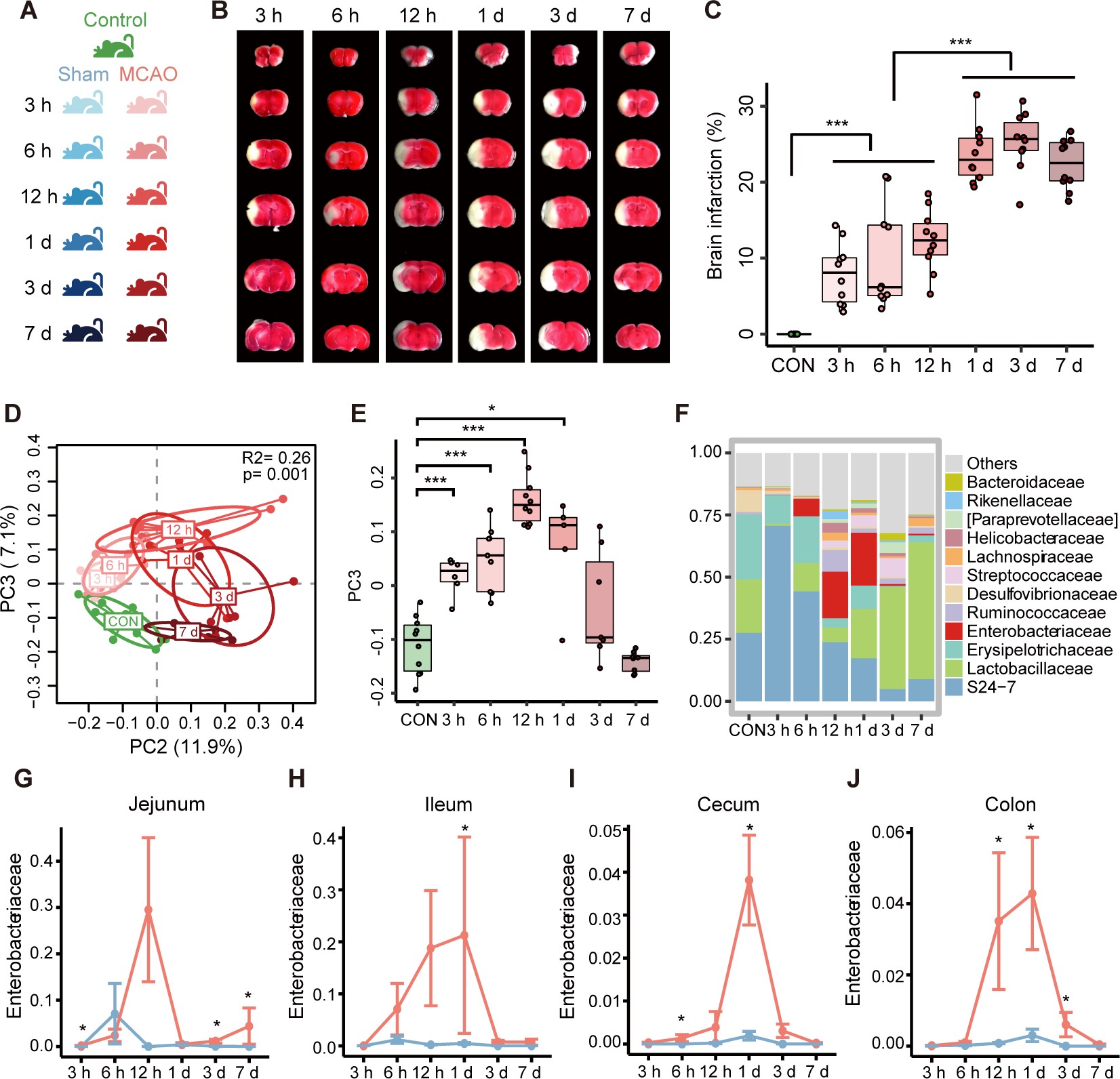
图1 | MCAO 小鼠出现快速肠道菌群失调,肠杆菌科急剧升高
研究进一步揭示了这一连锁反应的分子机制。脑部缺血导致自主神经调控失衡,引起肠道血流减少与氧化应激增强。大量自由基促使肠道内硝酸盐浓度升高,而肠杆菌能利用硝酸盐进行厌氧呼吸,从而在短时间内爆发式增长。这些细菌产生的脂多糖(LPS)通过 TLR4–NF-κB 通路触发全身炎症反应,血脑屏障被破坏,脑部缺血灶扩大。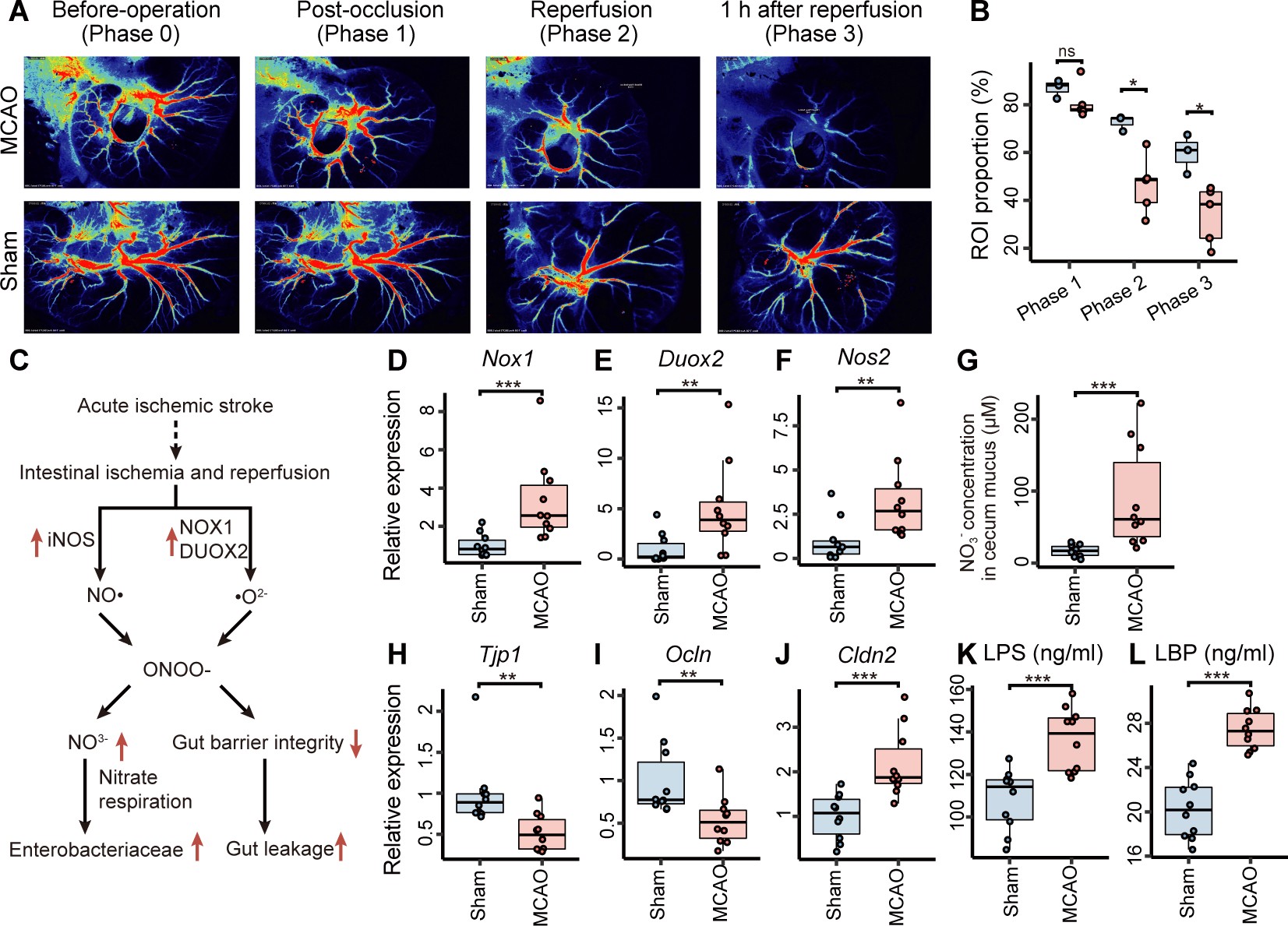
图2 | 缺血再灌注导致硝酸呼吸增强,促进肠杆菌科过度生长
更令人振奋的是,团队还找到了阻断这场“菌群风暴”的三种方法:
表1|三种干预药物及其作用机制
药物 主要机制 实验结果
胺基胍(AG) 抑制一氧化氮合酶,减少硝酸盐生成 显著降低肠杆菌扩增与脑梗面积
超氧化物歧化酶(SOD) 清除自由基,减轻肠道氧化应激 改善肠屏障与神经功能恢复
钨酸盐(W) 抑制细菌硝酸盐呼吸酶活性 阻止致病菌竞争性生长,保护脑组织
三种策略的共同点在于:靶向代谢信号,而非单纯杀菌。 通过恢复肠道微环境平衡,脑部炎症也得以缓解,显示出“肠–脑共治”的潜力。
这项研究还构建了一个完整的“肠–脑轴双向循环模型”:
① 脑→肠:卒中导致交感–迷走神经失衡与肠道缺血,再灌注产生活性氧与硝酸盐积累;
② 肠→脑:硝酸盐驱动的肠杆菌过度繁殖产生LPS与内毒素,经血流反馈至脑部,引发炎症、血脑屏障破坏与神经元死亡。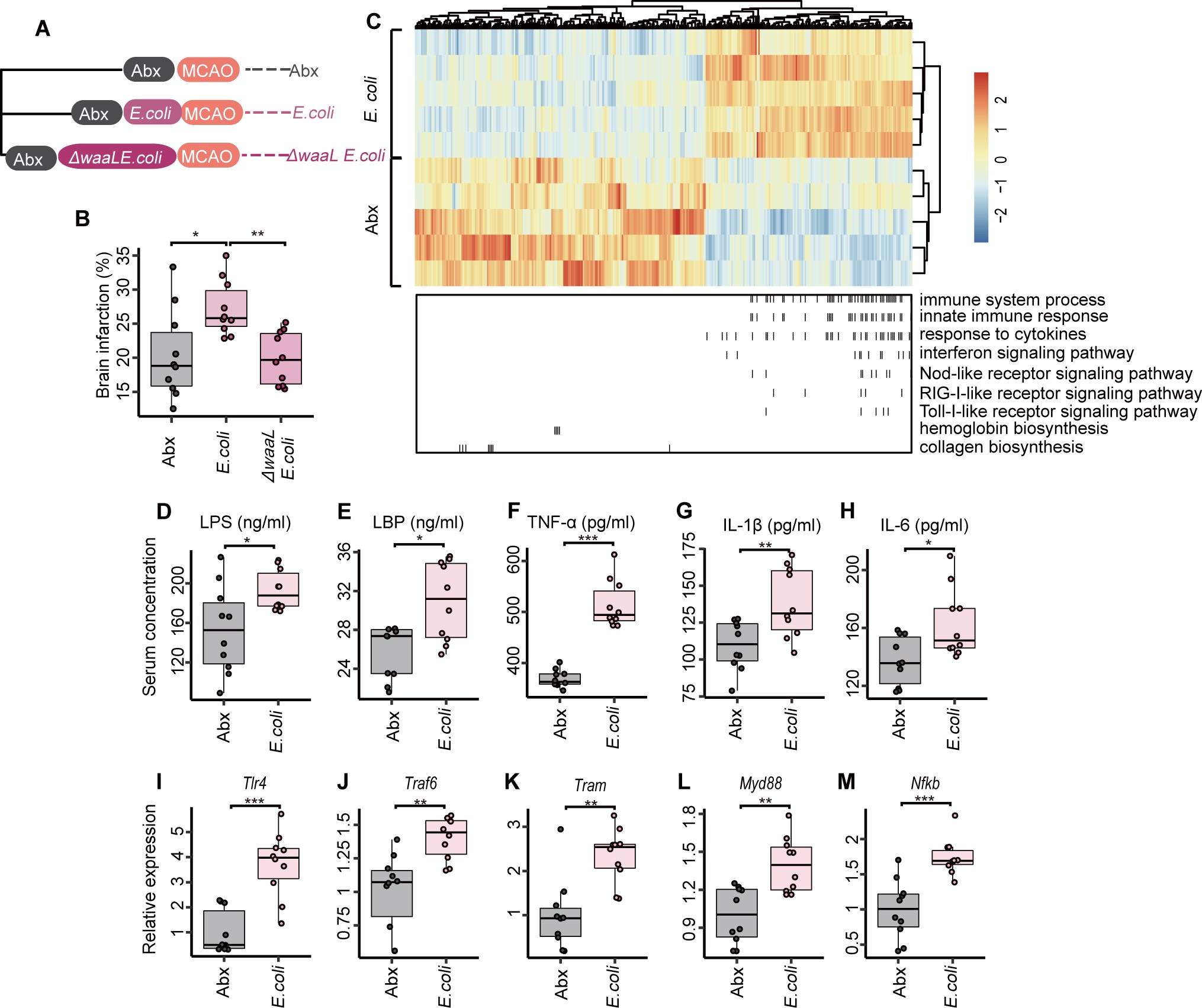
图3|卒中后的肠–脑轴恶性循环模型
用 E. coli 定殖小鼠后脑梗面积扩大,炎症因子(TNF-α、IL-1β、IL-6)升高。
LPS 与 LBP 水平升高,表明细菌产物进入血液。
免疫信号(TLR4-MyD88-NFκB 通路)被显著激活。
证据链:肠杆菌科过度生长 → 系统炎症增强 → 脑梗恶化。
临床验证进一步强化了这一机制。研究团队在卒中患者粪便样本中发现,肠杆菌丰度与梗死体积、神经功能评分呈正相关,而高水平硝酸盐代谢物是预后不良的独立指标。换句话说,卒中的严重程度可从粪便中“读出”。
这项发现不仅揭示了卒中后肠道变化的速度与深度,也重新定义了“肠脑轴”的方向——它并非单向信号传递,而是一种快速、可放大的生理反馈环。未来,卒中治疗或许不仅限于溶栓与神经保护,更要兼顾肠道代谢稳态的修复。
如作者总结:“Stroke speaks to the gut, and the gut replies to the brain.”——大脑与肠道在疾病的风暴中相互呼应,而医学的突破,可能正源于理解这场“对话”。
参考文献
Xie G., Zhou Q., Qiu Y., et al. (2021). Rapid gut dysbiosis induced by stroke exacerbates brain infarction in turn. Gut, 70(8), 1486–1498. https://doi.org/10.1136/gutjnl-2020-323363
本文所用图片均为文献内Figure
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
