过去十多年,Akkermansia muciniphila(阿克曼氏黏蛋白产菌)一直被誉为“下一代益生菌”的明星。从肥胖、糖尿病到脂肪肝,它在动物实验中展现出多面“护体”作用——改善胰岛素敏感性、减少脂肪堆积、修复肠屏障。然而,这一切都停留在小鼠体内。直到 2019 年,Patrice Cani 团队在 Nature Medicine 发表了首个人体随机双盲对照试验,为这一菌株跨越物种的疗效提供了实证支撑。
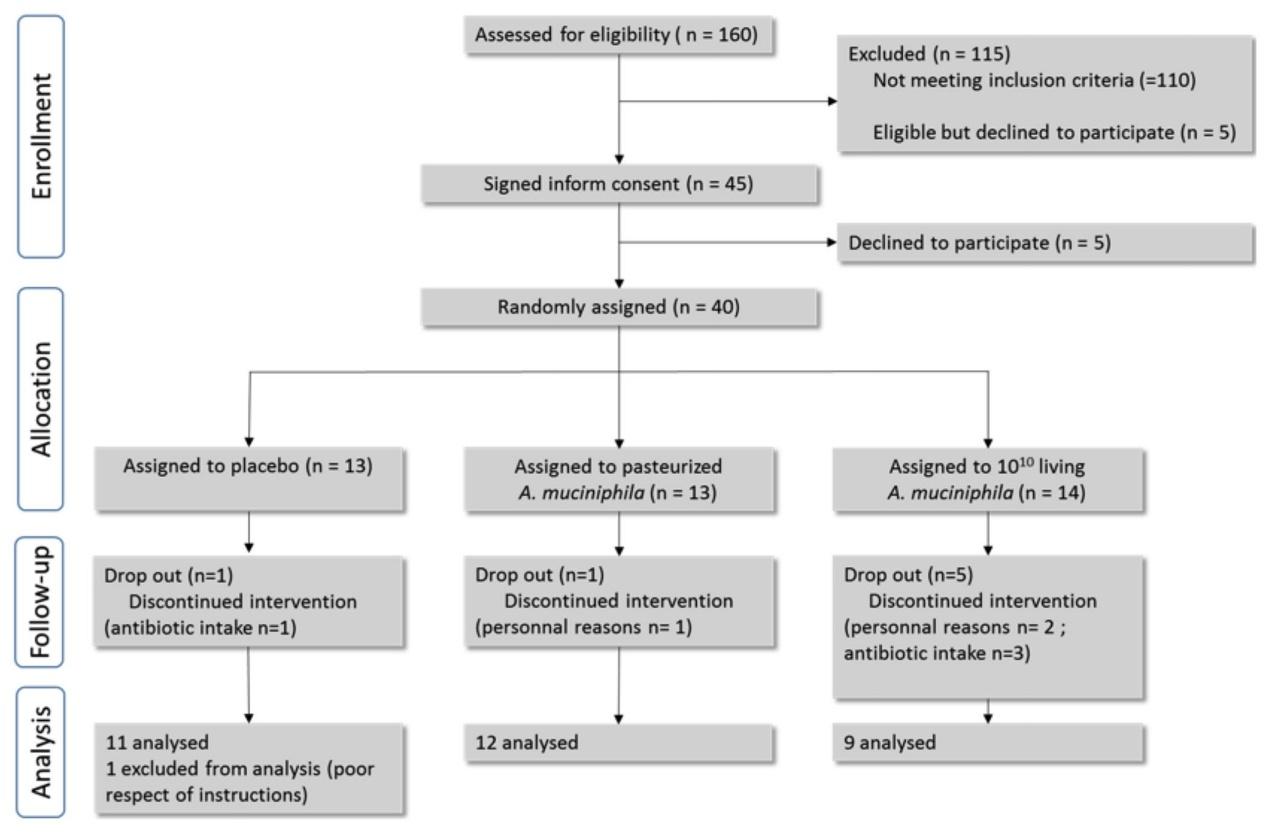
图1. Depommier等人,2019年《自然医学》的研究设计和参与者流程图。
这项研究纳入了 32 名超重或肥胖、伴有胰岛素抵抗的志愿者,随机分为三组:安慰剂组、活菌组(每日 10¹⁰ CFU)和巴氏灭活菌组(同剂量)。试验持续 3 个月,主要考察安全性、耐受性及代谢指标变化。所有受试者维持原有饮食与运动习惯。
结果首先明确了一个核心事实:无论活菌还是灭活菌,补充均安全、无不良反应,依从性高达 99%。而在代谢改善方面,“巴氏灭活菌”反而优于活菌——这是最令人意外的发现。
在 3 个月干预后:
灭活菌组胰岛素敏感性提升约 +29%(P=0.002),空腹胰岛素下降 −34%(P=0.006);
总胆固醇下降 −8.7%(P=0.02),γ-GT 与 AST 等肝酶显著降低;
白细胞计数下降,提示全身炎症水平减轻;
体重、脂肪量、臀围均略降(约 −2 kg、−1.4 kg、−2.6 cm,P≈0.09)。
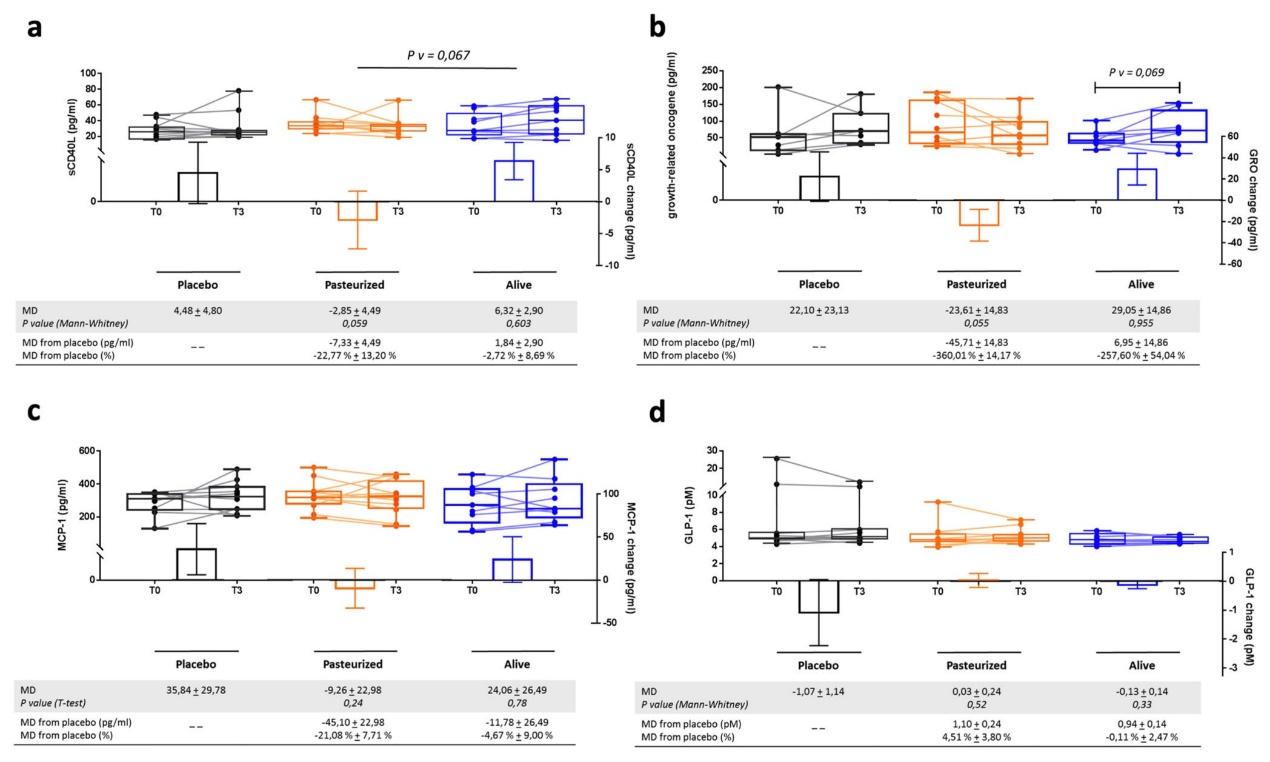
图2|关键代谢指标的变化:胰岛素敏感性(左)、总胆固醇(中)、肝酶与LPS(右)。
相比之下,活菌组虽有改善趋势,但统计学未显著。更有意思的是,两种形态的菌都未显著改变肠道菌群整体结构。这说明其效应不是通过“重新塑形”微生物生态,而可能源自直接的菌体组分作用。作者曾在小鼠中发现,灭活处理能暴露膜蛋白 Amuc_1100,使其更强地激活宿主的 TLR2 信号,从而强化肠屏障、降低炎症。这一机制在人体中或许同样发挥了作用。
研究还测得了血浆脂多糖(LPS)水平——这是“代谢性内毒素血症”的代表指标。灭活菌组的 LPS 明显下降,与肝功能改善相呼应,暗示其通过修复肠屏障 → 降低内毒素渗透 → 减轻肝脏炎症 → 改善胰岛素敏感性的链式效应。
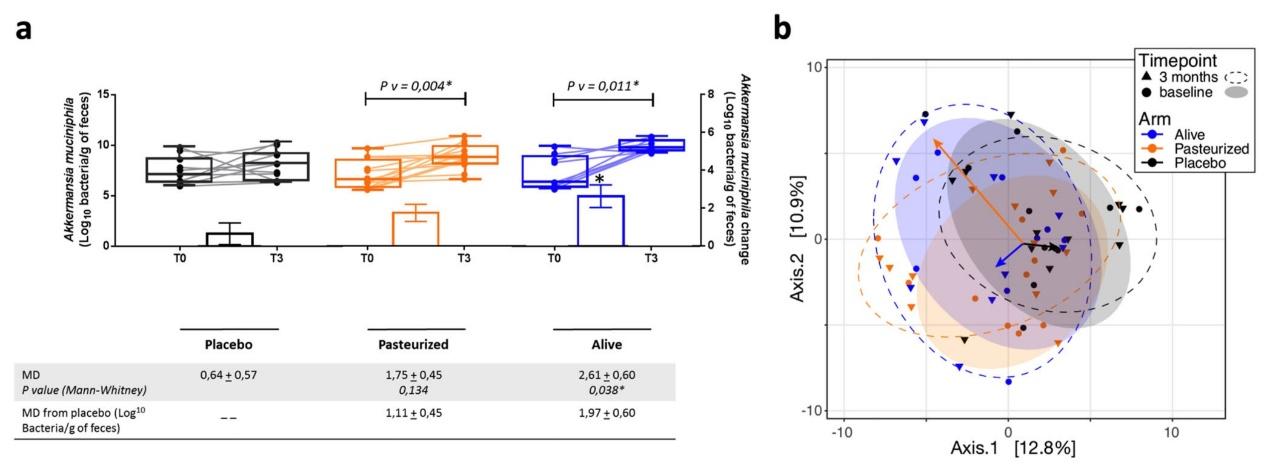
图3. 提出将巴氏杀菌的A. muciniphila与改善的代谢和肝功能参数相联系的机制。
这项研究的意义并非在于“减重”本身,而在于证明了一件关键的事——我们可以在不改变饮食、不过度干预菌群的前提下,通过单一菌株制剂改善人类代谢健康。更令人印象深刻的是,它首次在人类中证实了灭活益生菌的功能优越性:菌不一定要“活着”,才能有益。
当然,这只是“概念验证”。样本量小(32人)、观察期短(3个月)、未采用精确的脂肪分布测定(如DXA),意味着它还不足以支撑临床推广。但它打开了一扇门——未来的“益生菌药物”或许不再是活菌,而是更安全、稳定、可量化的“后生元(postbiotics)”。
结语:
从一株“吃黏液”的肠道共生菌,到被验证可改善人类胰岛素敏感性的代谢调节因子,Akkermansia muciniphila 的旅程刚刚开始。它提醒我们:肠道菌并非黑箱生态,而是可被精准设计的生物接口。
参考文献:
Depommier C, Everard A, Druart C, et al. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nature Medicine. 2019;25(7):1096–1103. doi:10.1038/s41591-019-0495-2.
本文所用图片均为文献内Figure
来源: 合康谱精准医学科普基地


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 合康谱精准医学科普基地
合康谱精准医学科普基地 
