全球变暖正在悄然改变自然界一些动物的性别比例。在澳大利亚北部,绿海龟孵化沙滩的温度持续升高,导致孵化出的幼龟中99%为雌性[1]。随着雄性数量锐减,这一物种正走向“性别失衡”的生态死角,繁衍能力遭遇严峻挑战。龟类作为典型的温度依赖型性别决定(temperature-dependent sex determination,TSD)物种,其胚胎性腺如同精密温度感受器——但温度如何转化为性别指令?
早期关于TSD的研究推测,温度感知可能由大脑或性腺旁组织负责,并通过脑-垂体-性腺轴或旁分泌途径调控性腺分化[2~4]。然而,后续的体外培养实验表明,性腺本身具备感知温度变化并据此决定分化方向的能力[5]。基于此,当前研究聚焦于胚胎发育期原始性腺的温度敏感机制。那么性腺里是谁在充当这个“温度感受器”呢? 以典型的TSD物种红耳龟(Trachemys scripta)为模型——其在26°C孵化时后代全为雄性,32°C时全为雌性——复旦大学杜卫国/东北林业大学杨仕隆课题组近期发表于Science Bulletin的两项研究[6,7],通过离体细胞筛选和单细胞转录组测序,在胚胎发育早期的性腺中找到了一群特殊的细胞,称之为“温敏类固醇生成细胞”(thermosensitive steroidogeniccells,TSSCs)。如图1所示,TSSCs表面装备着温度敏感钾离子通道KCNK3(potassium two poredomain channel subfamily K member 3)。这类通道就像是细胞膜上的“管家通道”,在正常生理状态下负责让钾离子外流,维持细胞膜电位的稳定。当温度降至雄性发育所需的阈值(如26°C)时,KCNK3通道功能被抑制。钾离子无法顺畅外流而在细胞内积聚,导致膜电位去极化。这种电位变化激活了电压敏感型钙离子通道,促使关键的第二信使钙离子(Ca2+)大量内流。由此,物理的温度信号通过离子通道的级联反应,被精准转化为细胞内的钙离子生物信号。
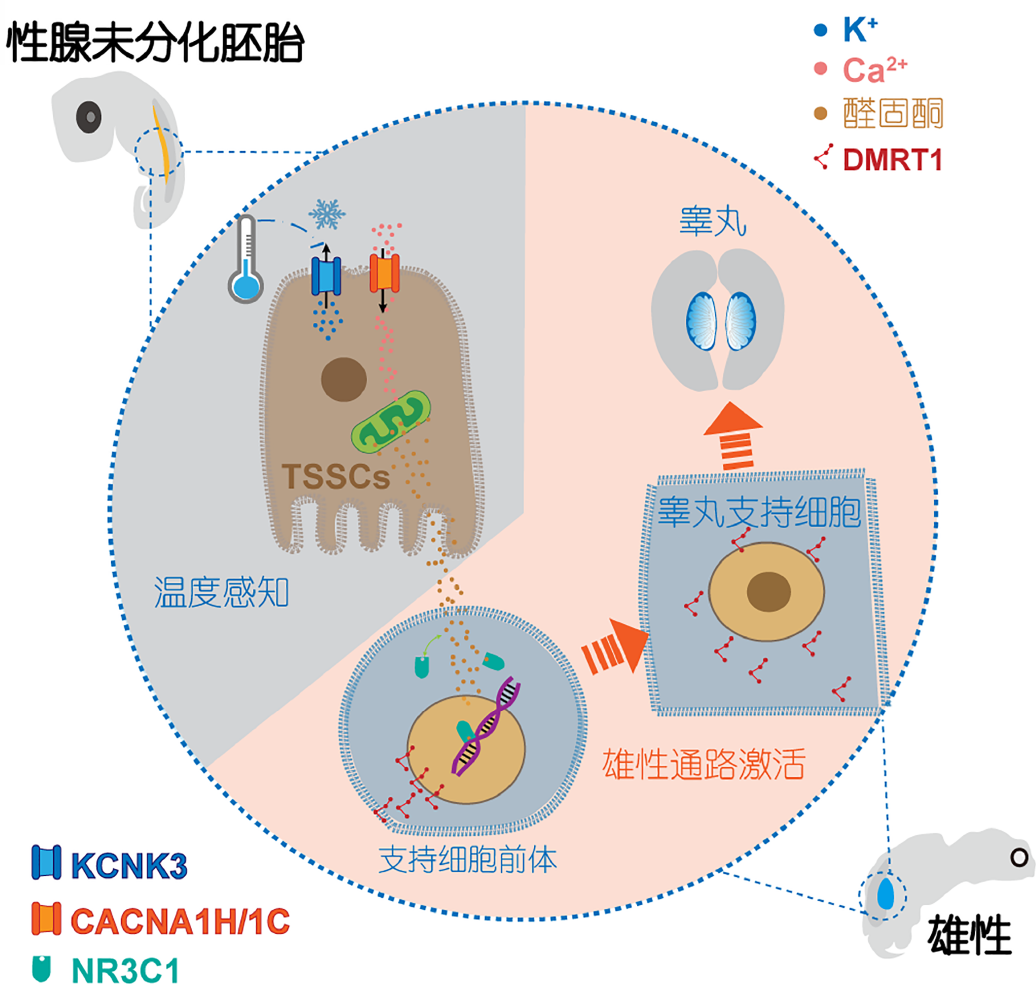
图1 雄性性别决定分子机制示意图
关键的钙离子信号激活后,驱动TSSCs合成了醛固酮(aldosterone)而非传统认为主导性别分化的性激素(如睾酮或雌激素),这是一个意外发现。单细胞RNA测序结果显示,TSSCs细胞高表达合成醛固酮所需的关键酶,却几乎不表达制造经典性激素的关键酶。这暗示了龟类演化出了一条独特的类固醇激素合成路径。酶联免疫吸附试验进一步证实: 在低温(雄性诱导环境)下,胚胎性腺中的醛固酮浓度显著升高,而睾酮、雌二醇等传统性激素的水平则没有显著变化。为了验证钙信号的核心作用,课题组进行了关键的药理学干预: 使用钙通道阻滞剂伊拉地平(isradipine)阻断钙离子内流,成功抑制了醛固酮的合成; 使用钾通道激动剂花椒碱(sanshool)在较高温度下模拟低温效应(即抑制钾通道功能),同样能诱导醛固酮分泌增加。这些实验直接证实钾离子通道和钙离子通道构成的级联反应,是精准调控醛固酮合成的关键分子开关。
那么,醛固酮又是如何启动雄性发育的呢? 已知DMRT1(doublesex-mab3-relatedtranscription factor 1)基因是启动睾丸发育、决定雄性命运的核心调控基因。研究发现醛固酮与其受体NR3C1(nuclear receptor subfamily 3,group C,member 1)结合形成的复合体,能够直接激活DMRT1基因的表达(图1),从而启动整个雄性发育程序。值得注意的是,龟类的NR3C1受体对醛固酮表现出特异性响应,这突破了哺乳动物中该受体主要结合糖皮质激素的传统认知。这种特异性可能根植于脊椎动物类固醇系统的演化历程: 哺乳动物的肾上腺与性腺虽然在成体分离,但在胚胎期共同起源于肾上腺-性腺原基(adrenogonadal primordium,AGP),提示二者早期发育中可能共享了类固醇调控通路[8]。此外,在部分硬骨鱼类中,肾上腺皮质激素具有保守的性别调控潜能,可诱导雌性向雄性的性别逆转[9]。随着脊椎动物从水生向陆生演化,肾脏结构的转变(前肾转变为后肾)促使肾上腺与肾脏分离并特化。在此背景下,龟类TSD机制中由醛固酮主导的性别决定途径,可能是陆生适应过程中类固醇信号通路功能分化的结果。
尽管这些分子关系错综复杂,但研究团队通过严谨的实验证实了这条通路的存在与功能。在产出1:1性比的28°C条件下,激活TSSCs钙信号(模拟低温),结果雄性比例大大增加。同样在28°C,直接添加外源醛固酮,也能显著提高雄性比例。在产全雄的26°C低温条件下,阻断醛固酮的合成或者阻断NR3C1受体,就能成功诱导相当一部分胚胎发育成雌性。这些强有力的干预实验证明,这条“温度→离子通道→钙信号→醛固酮→NR3C1受体→DMRT1基因→雄性”的通路,确实是温度决定龟类性别的核心机制。
这项研究首次完整解析了温度依赖型性别决定的分子通路,从性腺内特化的“温度计”细胞(TSSCs)感知环境变化,到离子通道将物理信号转化为生物化学信号(Ca2+),进而驱动非经典性激素醛固酮的合成,最终通过特异性受体激活雄性决定基因DMRT1。该工作阐明了TSD的一个核心分子机制。
【参考文献】
[1] Lockley E C, Eizaguirre C.Effects of global warming on species with temperature-dependent sexdetermination: bridging the gap between empirical research and management.Evolary Appl , 2021 , 14: 2361 -2377
[2] Crews D. The organizationalconcept and vertebrates without sex chromosomes. Brain Behav Evol , 1993 , 42:202 -214
[3] Gutiérrez-Ospina G,Jiménez-Trejo F J, Favila R, et al. Acetylcholinesterase-positive innervationis present at undifferentiated stages of the sea turtle Lepidochelis olivaceaembryo gonads: implications for temperature-dependent sex determination. J CompNeurol , 1999 , 410: 90 -98
[4] Merchant-Larios H, Fierro I V,Urruiza B C. Gonadal morphogenesis under controlled temperature in the seaturtle Lepidochelys olivacea. Herpetol Monogr , 1989 , 3: 43
[5] Shoemaker-Daly C M, Jackson K,Yatsu R, et al. Genetic network underlying temperature-dependent sexdetermination is endogenously regulated by temperature in isolated culturedTrachemys scripta gonads. Dev Dyn , 2010 , 239: 1061 -1075
[6] Li J, Ye Y Z, Zheng D, et al.Molecular basis for thermal switch of temperature-dependent sex determinationin a turtle species. Sci Bull , 2025
[7] Ye Y Z, Li J, Li W, et al.Transcriptional control of male-specific pathway in temperature-dependent sexdetermination. Sci Bull , 2025
[8] Bland M L, Desclozeaux M,Ingraham H A. Tissue growth and remodeling of the embryonic and adult adrenalgland. Ann New York Acad Sci , 2003 , 995: 59 -72
[9] Goikoetxea A, Todd E V,Gemmell N J. Stress and sex: does cortisol mediate sex change in fish?.Reproduction , 2017 , 154: R149 -R160
【封面图源pixabay】
来源: 《中国科学》杂志社


 科普中国公众号
科普中国公众号
 科普中国微博
科普中国微博

 帮助
帮助
 《中国科学》杂志社
《中国科学》杂志社 
